
| A、一定条件下,1.5 mol H2和0.5 mol N2充分反应后,可得到NH3的分子数为NA |
| B、常温常压下,18 g H2O中含有的电子总数为8NA |
| C、足量的Cu与Cl2反应生成0.2 mol产物时,失去的电子数为0.4NA |
| D、标准状况下,22.4 L己烯中含有的分子数为NA |


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
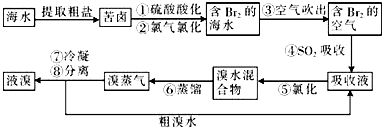
查看答案和解析>>
科目:高中化学 来源: 题型:
A、MgCl2(熔融)
| ||||
B、2AlCl3(熔融)
| ||||
C、HgO+CO
| ||||
D、2MgO+C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物的稳定性:B<E |
| B、最高价氧化物对应的水化物碱性:C<D |
| C、简单离子半径:E<D |
| D、均含有A,B,C,E四种元素形成的两种化合物可以相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铅有+2和+4两种价态,铅的常见氧化物四氧化三铅(Pb2O4)和二氧化铅(PbO2)均常用于蓄电池中,回答下列问题:
铅有+2和+4两种价态,铅的常见氧化物四氧化三铅(Pb2O4)和二氧化铅(PbO2)均常用于蓄电池中,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
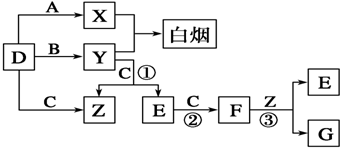
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向1mL 1% NaOH溶液加入2mL 2%的CuSO4溶液,振荡后滴加0.5mL葡萄糖溶液,加热 | 未出现红色沉淀 | 葡萄糖中不含有醛基 |
| B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| C | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液 | 红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com