
对由X、Y元素形成的化合物X2Y2的叙述正确的是()
A. 若是离子化合物,则阳阴离子个数比肯定不等于1:1
B. 若该化合物有Y﹣Y键,则肯定是共价化合物
C. 若溶于水时有X﹣Y键的断裂,则肯定是强电解质
D. 若X、Y原子间的共价键键能大,则熔、沸点肯定高
考点: 原子结构与元素的性质.
专题: 元素周期律与元素周期表专题.
分析: A.化学式用构成物质粒子的最简比表示;
B.若X2Y2为Na2O2,存在O﹣O键;
C.弱电解质在溶液中也可以发生电离;
D.分子晶体的熔点与共价键无关.
解答: 解:A.化学式用构成物质粒子的最简比表示,若为是离子化合物,则阳阴离子个数比肯定不等于1:1,若阳阴离子个数比等于1:1,则为XY,故A正确;
B.若X2Y2为Na2O2,存在O﹣O键,所以若该化合物有Y﹣Y键,则也可能是离子化合物,故B错误;
C.化学键断裂与强弱电解质无关,弱电解质在溶液中也可以发生断键而电离,故C错误;
D.该物质若为分子晶体,分子晶体的熔沸点与分子间作用力有关,共价键不影响物质的熔沸点,故D错误;
故选A.
点评: 本题考查了原子结构与性质关系,题目难度中等,B选项注意利用常见物质进行列举判断.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体通入BaCl2溶液,产生的沉淀为()
A. BaSO4 B. BaSO3 C. BaS D. BaSO4和BaSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表信息,下列叙述中正确的是()
序号 氧化剂 还原剂 氧化产物 还原产物
① Cl2 FeBr2 FeCl3
② KMnO4 H2O2 O2 MnO2
③ KClO3 浓盐酸 Cl2
④ KMnO4 浓盐酸 Cl2 MnCl2
A. 表中①反应的氧化产物只能有FeCl3
B. 表中②生成1mol的O2将有4mol的电子转移
C. 表中④的离子方程式配平后,H+的化学计量数为16
D. 表中③还原产物是KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O;②Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4;
③K2Cr2O7+FeSO4+H2SO4═Fe2(SO4)3+Cr2(SO4)3+K2SO4+H2O
(1)上述三个反应中,属于氧化还原反应的是 (填序号);
(2)配平反应③的化学方程式并用双线桥表示电子转移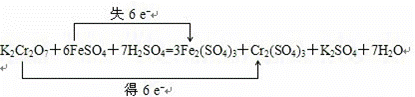 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 1.0L 1.0mo1•L﹣1的NaAlO2水溶液中含有的氧原子数为2NA
B. 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
C. 25℃时pH=13的NaOH溶液中含有OH﹣的数目为0.1NA
D. 1mol的羟基与1moL的氢氧根离子所含电子数均为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有一含NaCl、Na2CO3•10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.
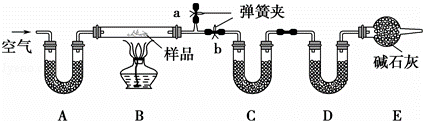
(1)加热前通入空气的目的是 ,操作方法为 .
装置A、C、D中盛放的试剂分别为:A ,C ,D .
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将 (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;若撤去E装置,则测得Na2CO3•10H2O的含量将 .
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3的质量分数为 % (用含w、m1、m2的代数式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com