
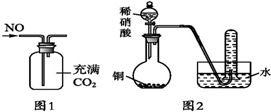
| A. | 汽车尾气中有NOx,主要是汽车打火时氮气和氧气反应引起的 | |
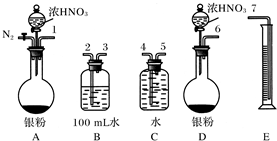
| B. | 可以用图1所示装置收集到干燥的NO气体 | |
| C. | 根据图2装置收集到的气体为无色能够验证铜和稀硝酸反应的产物中气态物质只有NO | |
| D. | 可以用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气 |
分析 A.氮气和氧气在放电条件下生成NO,一氧化氮和氧气反应生成二氧化氮;
B.NO的密度比二氧化碳小;
C.NO2与水反应会生成硝酸和NO;
D.溴单质可以将碘离子氧化为碘单质,但是NO2与水反应会生成硝酸,硝酸也可以将碘离子氧化为碘单质;
解答 解:A.氮气和氧气在放电条件下生成NOx气体,故A正确;
B.NO的密度比二氧化碳小,所以应该从短管进入,故B错误;
C.如果含有NO2,NO2与水反应会生成硝酸和NO,所以无法排除NO2的干扰,故C错误;
D.溴单质可以将碘离子氧化为碘单质,但是NO2与水反应会生成硝酸,硝酸也可以将碘离子氧化为碘单质,所以,不能用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气,故D错误.
故选A.
点评 本题考查汽车尾气NOx的产生原理、NO的制备和收集、NO2、Br2的鉴别等化学性质的知识,掌握基础是关键,题目难度中等.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(NH4+)>c(Cl-)>c(OH-)>c( H+) | B. | c(Cl-)>c(NH4+)>c( H+)>c(OH-) | ||
| C. | c(NH4+)+c( NH3)=c(Cl-)+c(OH-) | D. | c(NH4+)+c( NH3•H2O)+c( NH3)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 溶液中的化学反应大多是离子反应.根据要求回答下列问题.
溶液中的化学反应大多是离子反应.根据要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
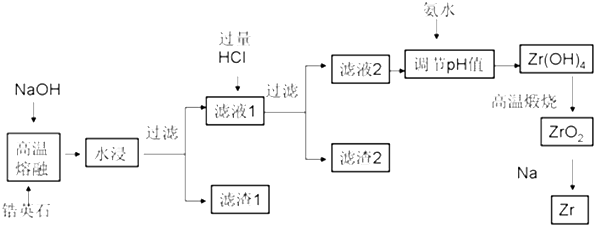
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | NaHCO3溶液中加入HCl:CO32-+2H+═CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:$ClO_3^-$+5Cl-+6H+═3Cl2↑+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com