

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 4.7 | 5.4 |
| 完全沉淀 | 3.2 | 9.7 | 6.7 | 8.0 |

| n |
| V |
| ||
| 0.05 |
| 2.4g |
| 160g/mol |
| n |
| V |
| 0.03mol |
| 0.05L |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
| A、0.913倍 |
| B、1.852倍 |
| C、0.873倍 |
| D、1.631倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 起始浓度(mol?L-1) 物质 | 甲 | 乙 | 丙 |
| A | 0.03 | 0.06 | 0.04 |
| B | 0.01 | 0.02 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后的溶液中不含Fe2+ |
| B、放出的NO气体的体积在标准状况为2.24L |
| C、稀硝酸的物质的量浓度为0.2mol?L-1 |
| D、所得溶液中Fe2+和Fe3+的物质的量之比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 NaOH 溶液:K+、Ba2+、Cl-、HCO3-. |
| B、0.1mol?L-1 Na2CO3 溶液:K+、NH4+、NO3-、SO42- |
| C、0.1mol?L-1 FeCl3溶液:K+、Na+、I-、SCN- |
| D、0.1mol?L-1HCl 溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH2CH=CH2+Br2→CH3- | |||
B、 +HNO3 +HNO3
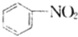 +H2O +H2O | |||
C、2CH3CH2OH+O2
| |||
D、CH3CH2OH+CH3COOH
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com