
【题目】为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是( )
选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
A | 向氯化亚铁溶液中通入氯气 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Fe2+具有还原性 |
C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe2+具有氧化性 |
A.AB.BC.CD.D
【答案】A
【解析】
A.向氯化亚铁溶液中通入氯气,浅绿色溶液变成棕黄色溶液,说明Fe2+具有还原性,发生的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故A正确;
B.在氯化亚铁溶液中加入锌片,浅绿色溶液变成无色溶液,说明Fe2+具有氧化性,发生的离子反应为Fe2++Zn=Fe+Zn2+,故B错误;
C.离子方程式电荷不守恒,正确的离子方程式为2Fe3++Fe=3Fe2+,故C错误;
D.在氯化铁溶液中加入铜粉,溶液颜色应由棕黄色变成蓝色,故D错误;
故答案为A。
【题型】单选题
【结束】
18
【题目】某无色的混合气体甲中可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(不考虑Na2O2与NO2、NO的反应)( )
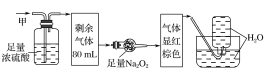
A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在指定溶液中能大量共存的是
A. 常温下,c(H+)/c(OH)=1×1012的溶液:K+、AlO2、CO32、Na+
B. 加入苯酚显紫色的溶液:K+、NH4+、Cl、I
C. 加入Al能放出大量H2的溶液中:NH4+、Na+、NO3、SO42
D. 常温下,pH=7的溶液:Cu2+、Fe3+、NO3、SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通入足量Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。针对上述一系列变化过程,下列说法不正确的是( )
A.上述过程中,最终被还原的是NO3-
B.从上述过程中可以得出氧化性:稀硝酸>稀硫酸>Fe3+
C.上述过程中,会产生一种无色的难溶于水的气体
D.若通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积比为3∶2
【答案】B
【解析】
A.SO2通入硝酸铁稀溶液中,溶液由棕黄色变为浅绿色,是因为Fe3+与SO2发生氧化还原反应生成SO42-、Fe2+;溶液立即又变为棕黄色,是因为Fe2+与NO3-、H+发生氧化还原反应生成Fe3+,所以最终被还原的是NO3-,故A正确;
B.SO2能够被Fe3+氧化成H2SO4,Fe2+能够被稀硝酸氧化成Fe3+,则氧化性:稀硝酸>Fe3+>稀硫酸,故B错误;
C.稀溶液中,NO3-在酸性环境中被还原为NO,NO是无色的难溶于水的气体,故C正确;
D.上述过程中,最终被还原的是NO3-,故整个过程相当于SO2和NO3-之间发生了氧化还原反应,由关系式3SO2~2NO3-可知,SO2与NO的体积比为3∶2,故D正确;
故答案为B。
【题型】单选题
【结束】
14
【题目】某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-的浓度,设计如图所示的实验方案:
![]()
则试剂X可以是( )
A.0.1mol·L-1KMnO4(H2SO4酸化)溶液
B.0.5mol·L-1NaOH溶液
C.新制氯水
D.KI溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
Ⅰ.干法脱硫
(1)已知:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l);ΔH1=akJ·mol-1
S(s)+O2(g)=SO2(g);ΔH2=bkJ·mol-1
则空气氧化脱除H2S反应2H2S(g)+O2(g)=2S(s)+2H2O(l)的ΔH=___kJ·mol-1。
(2)常用脱硫剂的脱硫效果及反应条件如表,则最佳脱硫剂为___。
脱硫剂 | 出口硫/(mg·m-3) | 脱硫温度/℃ | 操作压力(MPa) | 再生条件 |
一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸汽再生 |
活性碳 | <1.33 | 常温 | 0~3.0 | 蒸汽再生 |
氧化锌 | <1.33 | 350~400 | 0~5.0 | 不再生 |
锌锰矿 | <3.99 | 400 | 0~2.0 | 不再生 |
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生如下热分解反应:H2S(g)![]() H2(g)+
H2(g)+![]() S2(g)
S2(g)
控制不同的温度和压强进行实验,结果如图1所示。
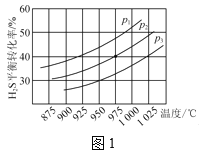
(1)p1、p2、p3由大到小的顺序为___。
()保持压强不变,能提高H2S的平衡转化率的措施有__(写一条)。
Ⅲ.间接电解法脱硫
间接电解法脱硫原理如图2所示(吸收反应器中盛放FeCl3溶液,电解反应器的阴极、阳极均为惰性电极)。
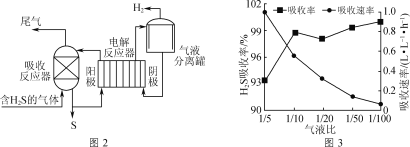
(1)吸收反应器中发生反应的离子方程式为___。
(2)反应器阴极生成H2的电极反应式为__。
(3)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图3所示。随着气液比减小,H2S的吸收率呈上升趋势的原因为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年 9 月,我国科研人员研制出 Ti-H-Fe 双温区催化剂,其中 Ti-H 区域和Fe 区域的温度差可超过100℃。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是
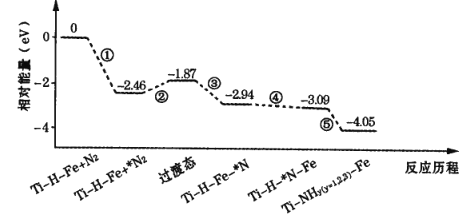
A.①②③在 Fe 区域发生,④⑤在Ti-H区域发生
B.在高温区加快了反应速率,低温区提高了氨的产率
C.该历程中能量变化最大的是2. 46eV,是氮分子中氮氮三键的断裂过程
D.使用 Ti-H-Fe 双温区催化合成氨,不会改变合成氨反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空:
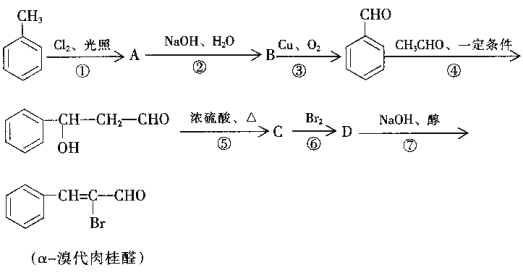
(1)反应①的类型是__________________,反应⑥的类型是____________________。
(2)C的结构简式是___________________,D的结构简式是___________。
(3)写出反应②的化学方程式:_________________________________________。
(4)反应⑦中,除生成α-溴代肉桂醛的同时,是否还有可能生成其他有机物?若有,请写出其结构简式:_______________________________。(只写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,常用如图所示装置制取并收集氨气。请回答下列问题:
(1)原理与方法
①制取氨气的化学方程式为__________________________________;
②该收集氨气的方法为________。
A.向上排空气法 B.向下排空气法
(2)装置与操作
按下图组装仪器,进行实验。仪器a的名称为____________。
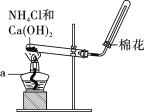
(3)思考与交流
①欲制取标准状况下4.48 L NH3,至少需要NH4Cl________g;
②实验室制取氨气,还可采用下图中的______(填“A”或“B”)。
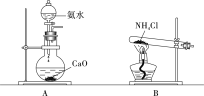
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com