解答:解:在短周期元素中,A和C的化合价都有-2价,应为第ⅥA族元素,C的最高价为+6价,C应为S元素,A无正价,A应为O元素;D和G的化合价都有+4、-4价,应为ⅣA族元素,且D的原子半径较大,故D为Si元素、G为碳元素;B有-1价,处于ⅦA族,原子半径大于碳原子,故B为Cl元素;E有+3价,处于ⅢA族,原子半径大于Si,故E为Al,F有+1价,处于ⅠA族,F与E的最高价氧化物对应水化物相互反应生成盐与水,则F应为Na,
(1)C为硫元素,处于周期表中第三周期第VIA族,
故答案为:第三周期第VIA族;
(2)常温下,上述几种元素形成的单质能与水反应的有:Na、Cl
2,
故答案为:Na、Cl
2;
(3)用电子式表示Na
2S的形成过程为:
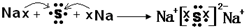
,
故答案为:
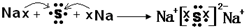
;
(4)非金属性Cl>S>Si,故最高价氧化物对应的水化物的酸性HClO
4>H
2SO
4>H
2SiO
3,NaOH溶液呈碱性,HClO
4、H
2SO
4溶液呈酸性,硫酸为二元强酸,二者浓度相同,硫酸的酸性更强,故pH由大到小的顺序为NaOH>HClO
4>H
2SO
4,
故答案为:HClO
4>H
2SO
4>H
2SiO
3;NaOH>HClO
4>H
2SO
4;
(5)Na
2O
2与水反应中过氧化钠其氧化剂、还原剂作用,各占一半,故1molNa
2O
2与水反应转移电子为1mol×
×2×[0-(-1)]=1mol,根据钠原子守恒可知生成NaOH为2mol,1L 0.5mol/LAlCl
3溶液中n(Al
3+)=1L×0.5mol/L=0.5mol,故n(Al
3+):n(OH
-)=0.5mol:2mol=1:4,反应生成偏铝酸钠,反应的离子方程式为:Al
3++4OH
-=AlO
2-+2 H
2O,
故答案为:1;Al
3++4OH
-=AlO
2-+2 H
2O;
(6)将Na单质放入AlCl
3溶液,反应完全后生成标况下0.672L气体,则氢气的物质的量=
=0.03mol,根据电子转移守恒可知n(Na)=2n(H
2)=0.06mol,故生成n(NaOH)=0.06mol,根据氢氧根守恒可知生成沉淀氢氧化铝的最大物质的量=
=0.02mol,故沉淀最大重量=0.02mol×78g/mol=1.56g,
故答案为:1.56;
(7)Na的同族元素M可以与碳元素形成多种化合物,则M为H元素,其中相对分子质量最小的分子为丙,其空间构型为正四面体型,则丙为CH
4,用氧气和CH
4可以制成原电池,电池中装有浓KOH溶液,用多孔的惰性电极浸入浓KOH溶液,在X极通入化合物CH
4,Y极通入氧气,CH
4发生氧化反应,碱性条件下生成碳酸根与水,则X极是该电池的负极,X极的电极反应式为:CH
4-8e
-+10OH
-=CO
32-+7H
2O,
故答案为:负;CH
4-8e
-+10OH
-=CO
32-+7H
2O.

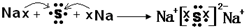 ,
,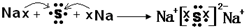 ;
;



