
工业上常用FeCl3溶液制印刷电路板并再生,主要过程如下:
腐蚀Cu:2FeCl3+Cu=CuCl2+2FeC12;
然后回收Cu:Fe+CuCl2=Cu+FeCl2;
再生FeC13:2FeC12+C12=2FeC13。
将某电路板上的Cu腐蚀完全,恰好消耗0.5L2mol/LFeCl3。全过程忽略体积的变化。
回答下列问题:
(1)画出Cl原子结构示意图:________________;
(2)将Cu腐蚀一半时,溶液中的金属阳离子有:_______________;此时c(Cl-)为:____________mol/L;
(3)腐蚀的Cu的总物质的量为:______________mol;
(4)再生FeC13时,溶液由___________色最终变为___________色;消耗的Cl2在标准状况下的体积至少为:________________L。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | bcde | B. | abde | C. | abc | D. | ace |
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:推断题
下图表示的是用明矾[KAl(SO4)2·12H2O]制取硫酸铝和硫酸钾的操作流程图,请根据此图回答有关问题。
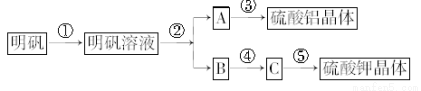
(1)进行操作②时,加入的试剂是 ,从反应混合物中分离A所进行的实验操作是________________________,其反应的离子方程式为 。
(2)进行操作④时,所加入的试剂是___________,其目的是_______________,同时要对反应混合物进行的操作是________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
将106 g的Na2CO3和84 g NaHCO3先经充分强热后,再分别跟足量的盐酸反应,下列说法错误的是( )
A.消耗盐酸一样多 B.放出CO2的总量一样多
C.后者生成的NaCl是前者的一半 D.后者消耗盐酸是前者的一半
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液体积/ml[ | 标准NaOH溶液体积读数(ml) | |
| 滴定前/ml | 滴定后/ml | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.30 | 22.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:CuFeS2$→_{800℃}^{O_{2}}$Cu2S$→_{△①}^{O_{2}}$Cu2O$→_{②}^{Cu_{2}S}$Cu查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:W<Z | |
| B. | 气态氢化物的稳定性:W>Z | |
| C. | 简单离子半径:Z>W>X>Y | |
| D. | X的氢化物中不可能含有非极性共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com