
 某研究性学习小组对“钠在空气中燃烧的产物”进行了探究.其实验过程为:取一小块钠在空气中加热片刻后与一定量的水反应,收集到V mL(标准状况)气体,向所得溶液中滴入1.000mol?L-1的盐酸溶液30.00mL恰好中和完全.实验装置如图所示.试回答下列问题:
某研究性学习小组对“钠在空气中燃烧的产物”进行了探究.其实验过程为:取一小块钠在空气中加热片刻后与一定量的水反应,收集到V mL(标准状况)气体,向所得溶液中滴入1.000mol?L-1的盐酸溶液30.00mL恰好中和完全.实验装置如图所示.试回答下列问题:| 成分 | |||
| 质量/g |
| 0.168L |
| 22.4L/mol |
| 成分 | Na2O | Na | Na2O2 |
| 质量/g | 0.31 | 0.23 | 0.39 |


科目:高中化学 来源: 题型:
| A、O3+2KI+H2O═2KOH+I2+O2 |
| B、2CH3COOH(醋酸)+Ca(ClO)2═2HClO+(CH3COO)2Ca |
| C、I2+2NaClO3═2NaIO3+Cl2 |
| D、4HCl(浓)+MnO2=△=MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1g水中含氧原子数为 NA/18 |
| B、NA个CO2分子和NA个CO分子质量比为11:7 |
| C、18g水中含电子数为8NA个 |
| D、1mol Fe2+带2NA个正电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2O4和 NO2 |
| B、CO和 N2 |
| C、CO2 和NO2 |
| D、NH4+ 和HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:
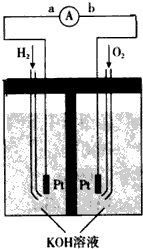 (1)氢氧燃料电池的能量转化主要形式是
(1)氢氧燃料电池的能量转化主要形式是
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7kJ/mol | ||
| B、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3kJ/mol | ||
C、N2H4(g)+NO2(g)=
| ||
| D、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
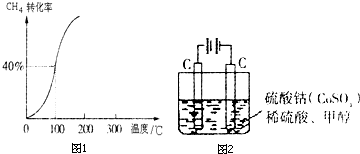
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com