
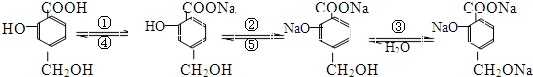
分析 (1)酸性:羧基>酚羟基>醇羟基;
(2)能与羧基反应的物质:钠、氢氧化钠、碳酸氢钠、碳酸钠溶液;能与酚羟基反应的物质:钠、氢氧化钠、碳酸钠溶液;能与醇羟基反应的物质:钠;
(3)苯酚能跟碳酸钠溶液反应,生成苯酚钠和碳酸氢钠;
(4)乙醇钠与水反应生成乙醇和氢氧化钠.
解答 解:(1)提供质子的能力就是电离出氢离子的能力,即酸性:a>b>c,故答案为:a>b>c;
(2)该反应过程为: 中只有羧基与①生成
中只有羧基与①生成 ,:①是碳酸氢钠;
,:①是碳酸氢钠; 能与稀盐酸或稀H2SO4反应生成
能与稀盐酸或稀H2SO4反应生成 ;
; 中只有酚羟基与②反应生成
中只有酚羟基与②反应生成 ,②为碳酸钠或者氢氧化钠,
,②为碳酸钠或者氢氧化钠, 和试剂⑤反应生成
和试剂⑤反应生成 ,酚钠溶液和二氧化碳反应生成酚羟基,羧酸钠溶液和二氧化碳不反应,所以试剂⑤是二氧化碳或碳酸;
,酚钠溶液和二氧化碳反应生成酚羟基,羧酸钠溶液和二氧化碳不反应,所以试剂⑤是二氧化碳或碳酸; 中只有醇羟基与③反应生成
中只有醇羟基与③反应生成 ,③为钠,故答案为:NaHCO3溶液;NaOH或Na2CO3溶液;Na;稀盐酸或稀H2SO4;CO2;
,③为钠,故答案为:NaHCO3溶液;NaOH或Na2CO3溶液;Na;稀盐酸或稀H2SO4;CO2;
(3)苯酚能跟碳酸钠溶液反应,生成苯酚钠和碳酸氢钠,反应离子方程式为C6H5-OH+CO32-→-C6H5O-+HCO3-,故答案为:C6H5-OH+CO32-→-C6H5O-+HCO3-;
(4)乙醇钠与水反应生成乙醇和氢氧化钠,反应方程式为CH3CH2ONa+H2O→CH3CH2OH+NaOH,故答案为:CH3CH2ONa+H2O→CH3CH2OH+NaOH.
点评 本题考查了羧基、酚羟基、醇羟基性质的区别和有机物之间的转化,题目难度中等,注意各种官能团的性质是本题解题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④⑥ | C. | ①②⑥ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4H是共价化合物 | B. | NH4H溶于水,所形成的溶液显碱性 | ||
| C. | NH4H与水反应时,水作还原剂 | D. | NH4H中的H元素只有一种化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 3:2 | C. | 3:4 | D. | 5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
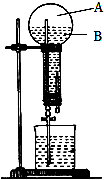 如图是做过氨气溶于水的喷泉实验装置,实验完成后烧瓶里的空间被分为两个部分:A和B,请根据实验内容按要求填空:
如图是做过氨气溶于水的喷泉实验装置,实验完成后烧瓶里的空间被分为两个部分:A和B,请根据实验内容按要求填空: NH4++OH-(用离子方程式表示);
NH4++OH-(用离子方程式表示);查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com