
分析 发生2Na2O2+2H2O═4NaOH+O2↑,n(Na2O2)=$\frac{7.8g}{78g/mol}$=0.1mol,溶液的溶质为NaOH,结合反应及c=$\frac{n}{V}$计算.
解答 解:n(Na2O2)=$\frac{7.8g}{78g/mol}$=0.1mol,由2Na2O2+2H2O═4NaOH+O2↑可知,生成气体为0.1mol×$\frac{1}{2}$×22.4L/mol=1.12L,
溶液的溶质为NaOH,其物质的量浓度为$\frac{0.1mol×2}{0.5L}$=0.4mol/L,
故答案为:1.12;NaOH;0.4.
点评 本题考查化学反应方程式及物质的量的计算,为高频考点,把握发生的反应及物质的量的相关计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰可用作致冷剂 | B. | 在铁制容器表面刷铝粉可防止生锈 | ||
| C. | 氢氧化钠可用作医用胃酸中和剂 | D. | 过氧化钠可用作供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
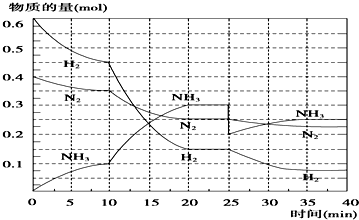
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 催化剂对反应的影响 | 平衡体系增加N2对反应的影响 |
| 图示 |  |  |  |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com