
|
已知0.5 mol硝酸铵在一定条件下可分解成0.2 mol硝酸和16.2 g水以及另外一种气态物质,则该气态物质是( ). | |
A. |
N2 |
B. |
N2O |
C. |
NO |
D. |
NO2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:上海市浦东新区2012届高三4月(二模)质量抽测化学试题 题型:038
防治环境污染是当前环保工作的重要研究内容之一.二氧化硫和氮氧化物是大气的主要污染物.
1.将1.5 mol SO2用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到________g石膏(CaSO4·2H2O).
2.用CH4消除NOx污染的化学方程式为:CH4+4NO→2N2+CO2+2H2O;CH4+2NO2→N2+CO2+2H2O现有11.2 L NO2、NO的混合气体NOx,将其还原为N2,需要4.48 L的CH4,则混合气体中NO2、NO的物质的量分别为________.(体积都已换算为标准状况)
3.(1)常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4.若2 mol ZnFe2Oy与足量NO2可生成0.5 mol N2,则y=________.
(2)氧缺位铁酸锌ZnFe2Oz化学式的氧化物形式为aZnO·bFeO·cFe2O3.已知1 mol ZnFe2Oz最多能使4.0 L(标况)NO1.4转化为N2.则上述氧化物形式的化学式可具体表示为________.
4.低温臭氧氧化脱硫脱硝技术可以同时吸收烟气中的氮氧化物和二氧化硫,反应原理是将NOx氧化成N2O5,通过洗涤形成硝酸盐,二氧化硫形成硫酸盐.其主要反应如下:
NO+O3→NO2+O2 ①
2NO2+O3→N2O5+O2 ②
N2O5+2NH3+H2O→2NH4NO3 ③
SO2+O3+2NH3+H2O→(NH4)2SO4+O2 ④
某热电厂烟气中平均含NOx 4.5‰、SO2 9.0‰(体积分数),压缩空气经臭氧发生器变成臭氧空气,其中O3浓度为90 L/m3,臭氧空气与加湿氨气和烟气混合反应.若![]() 流量比为y,请通过计算列出y与x的关系式.
流量比为y,请通过计算列出y与x的关系式.
查看答案和解析>>
科目:高中化学 来源:2012届上海市浦东新区高三下学期4月质量抽测化学试卷(带解析) 题型:填空题
(本题共16分)防治环境污染是当前环保工作的重要研究内容之一。二氧化硫和氮氧化物是大气的主要污染物。
1.将1.5 mol SO2用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到_________________g石膏(CaSO4?2H2O)。
2.用CH4消除NOx污染的化学方程式为:
CH4+4NO → 2N2+CO2+2H2O; CH4+2NO2 → N2+CO2+2H2O
现有11.2 L NO2、NO的混合气体NOx,将其还原为N2,需要4.48 L 的CH4,则混合气体中NO2、NO的物质的量分别为___________________。(体积都已换算为标准状况)
3.(1)常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5 mol N2,则y=_______________。
(2)氧缺位铁酸锌ZnFe2Oz化学式的氧化物形式为aZnO?bFeO?cFe2O3。已知1 mol ZnFe2Oz最多能使4.0 L(标况)NO1.4转化为N2。则上述氧化物形式的化学式可具体表示为______________________________。
4.低温臭氧氧化脱硫脱硝技术可以同时吸收烟气中的氮氧化物和二氧化硫,反应原理是将NOx氧化成N2O5,通过洗涤形成硝酸盐,二氧化硫形成硫酸盐。其主要反应如下:
NO+O3 → NO2+O2 ……………………………………………①
2NO2+O3 → N2O5+O2 …………………………………………②
N2O5+2NH3+H2O → 2NH4NO3 ………………………………③
SO2+O3+2NH3+H2O → (NH4)2SO4+O2 ……………………④
某热电厂烟气中平均含NOx 4.5‰、SO2 9.0‰(体积分数),压缩空气经臭氧发生器变成臭氧空气,其中O3浓度为90 L/m3,臭氧空气与加湿氨气和烟气混合反应。若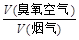 流量比为y,请通过计算列出y与x的关系式。
流量比为y,请通过计算列出y与x的关系式。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省扬州市高二下学期期中考试化学试卷(解析版) 题型:填空题
(15分)研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
⑴I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
⑵一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 ,
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
⑶从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)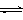 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
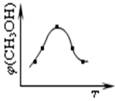
①取五份等体体积CO2和H2的的混合气体 (物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
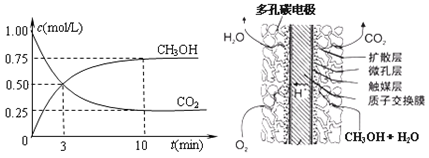
②在容积为1L的恒温密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下左图所示。若在上述平衡体系中再充0.5 mol CO2和1.5 mol H2O(g) (保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)
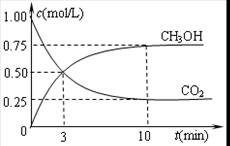
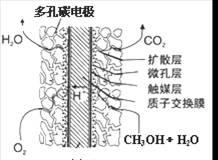
③直接甲醇燃料电池结构如上右图所示。其工作时负极电极反应式可表示为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市浦东新区高三下学期4月质量抽测化学试卷(解析版) 题型:填空题
(本题共16分)防治环境污染是当前环保工作的重要研究内容之一。二氧化硫和氮氧化物是大气的主要污染物。
1.将1.5 mol SO2用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到_________________g石膏(CaSO4•2H2O)。
2.用CH4消除NOx污染的化学方程式为:
CH4+4NO → 2N2+CO2+2H2O; CH4+2NO2 → N2+CO2+2H2O
现有11.2 L NO2、NO的混合气体NOx,将其还原为N2,需要4.48 L 的CH4,则混合气体中NO2、NO的物质的量分别为___________________。(体积都已换算为标准状况)
3.(1)常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5 mol N2,则y=_______________。
(2)氧缺位铁酸锌ZnFe2Oz化学式的氧化物形式为aZnO•bFeO•cFe2O3。已知1 mol ZnFe2Oz最多能使4.0 L(标况)NO1.4转化为N2。则上述氧化物形式的化学式可具体表示为______________________________。
4.低温臭氧氧化脱硫脱硝技术可以同时吸收烟气中的氮氧化物和二氧化硫,反应原理是将NOx氧化成N2O5,通过洗涤形成硝酸盐,二氧化硫形成硫酸盐。其主要反应如下:
NO+O3 → NO2+O2 ……………………………………………①
2NO2+O3 → N2O5+O2 …………………………………………②
N2O5+2NH3+H2O → 2NH4NO3 ………………………………③
SO2+O3+2NH3+H2O → (NH4)2SO4+O2 ……………………④
某热电厂烟气中平均含NOx 4.5‰、SO2
9.0‰(体积分数),压缩空气经臭氧发生器变成臭氧空气,其中O3浓度为90 L/m3,臭氧空气与加湿氨气和烟气混合反应。若 流量比为y,请通过计算列出y与x的关系式。
流量比为y,请通过计算列出y与x的关系式。
查看答案和解析>>
科目:高中化学 来源:江苏期中题 题型:填空题
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3 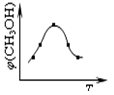
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com