
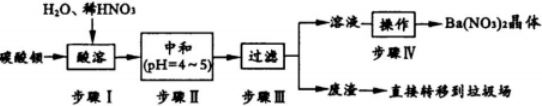
分析 BaC03含少量CuC03、Ba(FeO2)2等杂质,其中Ba(FeO2)2中钡元素为+2价,铁元素为+3价,加入硝酸,在容器中充分溶解得到溶液,此溶液中含有钡离子、铜离子、三价铁离子,可加入碳酸钡,调节溶液pH=4~5,使铁离子、铜离子水解生成Fe(OH)3沉淀、Cu(OH)2沉淀,过滤后废渣为Fe(OH)3、Cu(OH)2,滤液中主要含有硝酸、硝酸钡,经蒸发浓缩,冷却结晶,过滤可得到硝酸钡晶体,
(1)Ba(FeO2)2中钡元素为+2价,铁元素为+3价,步骤I中发生的反应都不是氧化还原反应,在产物中生成的都是硝酸盐,则硝酸只体现了酸性;
(2)检验三价铁通常用硫氰化钾溶液;
(3)步骤IV中得到Ba(N03)z晶体的操作依次为蒸发浓缩,冷却结晶,过滤;阴极发生还原反应,能使红色石蕊试纸变蓝的气体是氨气,说明是溶液中硝酸根放电;
(4)闪光粉是由Ba(N03)2与Al粉混合而成,受热可以产生N2和另外两种氧化物,利用化合价升降配平方程式为:3Ba(NO3)2+10Al=3N2+5Al2O3+3BaO,
①4NO2 (g)+O2 (g)+2BaO(s)=2Ba(N03)2(s)△H=+akJ/mol
②4Al(s)+302 (g)=2Al203(s)△H=-bkJ/mol
③N2 (g)+2O2(g)=2N02 (g)△H=-ckJ/mol
用盖斯定律构造目标反应,应是②×2.5-③×3-①×1.5得到热化学反应方程式;
(5)Ba2+可以服用MgS04溶液解毒,涉及到的离子反应方程式为:Ba2++SO42-=BaSO4↓;
解答 解:(1)Ba(FeO2)2中钡元素为+2价,铁元素为+3价,步骤I中HN03与BaC03、CuC03发生复分解反应,与Ba(FeO2)2反应的方程式为:Ba(FeO2)2+8HNO3 =Ba(NO3)2+2Fe(NO3)3+4H2O,这些反应中各元素化合价都没有变化,都不是氧化还原反应,在产物中生成的都是硝酸盐,则硝酸只体现了酸性,
故答案为:+3;酸性;
(2)检验三价铁通常用硫氰化钾溶液,具体操作是:取少量溶液于试管,滴加几滴KSCN溶液,振荡,如果溶液出现红色则含有Fe3+,否则不含Fe3+,
故答案为:取少量溶液于试管,滴加几滴KSCN溶液,振荡,如果溶液出现红色则含有Fe3+,否则不含Fe3+;
(3)步骤IV中得到Ba(N03)z晶体的操作依次为蒸发浓缩,冷却结晶,过滤;阴极发生还原反应,能使红色石蕊试纸变蓝的气体是氨气,说明是溶液中硝酸根放电,则电极反应式为:NO3-+6H2O+8e-=NH3↑+9OH-,
故答案为:蒸发浓缩,冷却结晶,过滤;NO3-+6H2O+8e-=NH3↑+9OH-;
(4)闪光粉是由Ba(N03)2与Al粉混合而成,受热可以产生N2和另外两种氧化物,利用化合价升降配平方程式为:3Ba(NO3)2+10Al=3N2+5Al2O3+3BaO,
①4NO2 (g)+O2 (g)+2BaO(s)=2Ba(N03)2(s)△H=+akJ/mol
②4Al(s)+302 (g)=2Al203(s)△H=-bkJ/mol
③N2 (g)+2O2(g)=2N02 (g)△H=-ckJ/mol
用盖斯定律构造目标反应,应是②×2.5-③×3-①×1.5,得到3Ba(NO3)2(s)+10Al(s)=3N2(g)+5Al2O3(s)+3BaO(s)△H=-(1.5a+2.5b-3c)kJ/mol,
故答案为:-(1.5a+2.5b-3c)kJ/mol;
(5)Ba2+可以服用MgS04溶液解毒,涉及到的离子反应方程式为:Ba2++SO42-=BaSO4↓;过滤得到的废渣上含硝酸,应洗涤废渣并回收洗涤液,
故答案为:Ba2++SO42-=BaSO4↓;
点评 本题考查学生在“工艺流程阅读、相关化学反应、除杂的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,综合考查学生对新信息的处理能力、分析能力和实验能力,题目难度中等,注意把握实验原理和方法.


科目:高中化学 来源: 题型:解答题
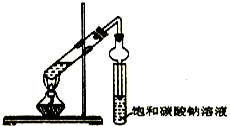 某同学用下列所示实验装置制取乙酸乙酯.回答以下问题:
某同学用下列所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3(g)═N2(g)+3H2(g)是熵增的反应 | |
| B. | △H、△S分别取“负”时反应一定能自发进行 | |
| C. | 在醋酸溶液中存在两种分子 | |
| D. | 相同温度下,pH值相等的盐酸和醋酸,其浓度是醋酸大于盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | N三N | N-H |
| 键能/(kJ•mol-1) | 436 | 945.6 | 391 |
| A. | +192.4 kJ•mol-1 | B. | +92.4kJ•mol-1 | C. | -92.4kJ•mol-1 | D. | -192.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
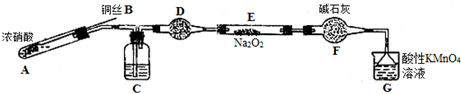
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为AlCl3,则丁可能是浓氨水 | ||
| C. | 若甲为SO2,则丁可能是氨水 | D. | 若甲为NaOH 溶液,则丁可能是H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com