
(每空2分,共16分)
A、B、C、D、E、X 都是短周期元素组成的常见无机物
根据上框图关系,完成下列问题:
(1)A可作漂白剂,X是含有某种阳离子(此阳离子具有净水作用)的溶液,且M(A)=M(D),
则A与H2O反应的化学方程式为 ,C转化成D的离子方程式为
(2)A的某种合金可作原子反应堆的导热剂,X是非极性分子的化合物,则A与H2O反应的离子方程式为 ,C转化成D的化学方程式为
(3)A是单质,X是Na2CO3溶液,E可用消毒剂,则A与H2O反应的离子方程式为
,
(4)A是单质,X是单质(它的同素异形体是原子晶体),则E与SiO2反应的化学方程式为
(5)A是化合物,X是O2,C转化成D还需要催化剂,E具有两性,则A与H2O反应的化学方程式为
(6)A是化合物(Mr(A)=100),X是O2,B转化成C还需要催化剂,E是中强碱,则A
与H2O反应的化学方程式为
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源:河北省冀州中学10-11学年高一下学期期末考试(化学理)B卷 题型:填空题
(每空2分,共16分)依据事实,填空:
(1)在25℃、101kPa下,1g甲醇液体完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(3)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式: 正极: ;负极:
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省玉溪一中高二上学期期末考试化学试卷(带解析) 题型:实验题
(每空2分,共16分)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH===CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO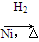 CH3CH2CH2CH2OH:
CH3CH2CH2CH2OH:
CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。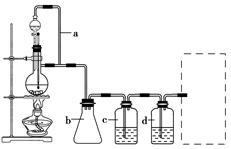
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯。写出化学方程式: ____________________________________________________________________________。
(2)若用以上装置制备H2,在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓ ;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线: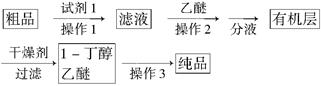
试剂1为________,操作1为________,操作2为________,操作3为________。
查看答案和解析>>
科目:高中化学 来源:2013届湖南省湘中名校高三9月第一次联考化学试卷(带解析) 题型:实验题
(每空2分,共16分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。 [方案一]
[方案一] 〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。 实验中发生反应的化学方程式是 。
实验中发生反应的化学方程式是 。 〖实验步骤〗
〖实验步骤〗 (1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将  (填“偏高”、“偏低”或“无影响”)。
(填“偏高”、“偏低”或“无影响”)。 [方案二
[方案二
 ]
]
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 105Pa)的体积。
105Pa)的体积。 〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:
〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:





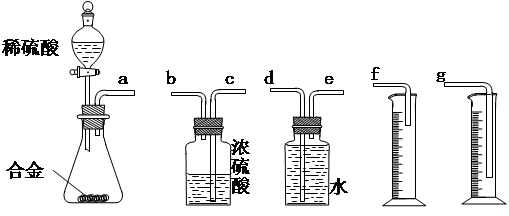

 ①你认为最简易的装置其连接顺序是:a接( )( )接( )( )接( )(填接口字母,可不填满。)
①你认为最简易的装置其连接顺序是:a接( )( )接( )( )接( )(填接口字母,可不填满。) ②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因 。
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因 。 ③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是 。
A.等待实验装置冷却 | B.上下移动量筒f,使其中液面与广口瓶中液面相平 | C.上下移动量筒g,使其中液面与广口瓶中液面相平 | D.视线与凹液面的最低点水平读取量筒中水的体积 |
 (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。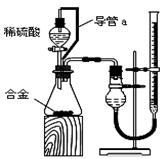
 ①装置中导管a的作用是 。
①装置中导管a的作用是 。 ②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。



查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃省天水市高三模拟(5月)考试化学试卷(解析版) 题型:填空题
(每空2分,共16分)短周期元素X、Y、Z、W,原子序数依次增大。常温常压下,只有W的单质为气体。它们的最高氧化物对应的水化物依次为甲、乙、丙、丁。甲、乙、丙是中学化学中的常见物质,其中只有乙难溶于水,且能和甲、丙反应得到澄清溶液。根据以上信息填写下列空白:
⑴画出W的原子结构示意图_________________________________________;
⑵将乙和甲、丙分别反应后得到的溶液混合,观察到的现象是___________________
___________________ ,两溶液混合时所发生反应的离子方程式为____________________________________________________;
⑶下列事实能证明Z和W非金属性强弱的是(选填序号)__________________________;
A.单质的熔点:Z>W2 B.酸性:丁>丙
C.在溶液中:W2+H2Z=2HW+Z
D.稳定性:HW>H2Z E.氢化物水溶液的酸性:HW>H2Z
F.溶解性:丁>丙
⑷用Y单质和生活中最常用的金属作电极,用导线连接插入甲的溶液中构成原电池,该原电池负极的电极反应式为_______________________________________________ ;
⑸工业上以XW为原料可以进行许多化生产,甲和W2都是其主要产品。写出工业上以XW为原料生产甲和W2的化学方程式_______________________________________________
_______________________________________________;若要生产80.0 kg甲物质,至少需要XW______________kg,同时可得W2_____________m3(标况)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃省天水市高三模拟(5月)考试化学试卷(解析版) 题型:推断题
(每空2分,共16分)有X、Y、Z三种单质和甲、乙、丙三种常见的化合物,它们有如下图及叙述所示的关系:

(1).X、Y、Z都是短周期元素的单质,X元素原子的最外层电子数是其次外层电子数的2倍;Y元素有两种常见单质,二者质量相等时其物质的量之比为3 :2;Z元素原子的次外层电子数是其最外层电子数的4倍。则:
①写出化合物甲的电子式___________________;
②写出Z与甲反应的化学方程式__________________________________________________;
(2).X、Y、Z都是非金属单质,X是原子晶体,Y、Z都是分子晶体,X、Y都能与强碱溶液反应;乙的水溶液是工业三酸之一,也是实验室常用试剂。则:
①写出X与NaOH溶液反应的离子方程式________________________________________;
②Z与甲的反应的一种重要工业用途是___________________________________________;
③在①所得溶液中加入乙的溶液,观察到的现象______________________________________________________________________ ;
(3).X、Z是常见金属,Z与甲的反应只有在高温下才能进行,甲是一种具有磁性的化合物,乙在工业上常用于制取Z单质。则:
①写出乙与NaOH溶液反应的化学方程式_________________________________________________ ;
②将①所得溶液与小苏打溶液的混合观察到的现象是___________________________________ ;
③将等物质的量的X和Z分别与足量的稀硫酸反应,当两种金属完全溶解后,得到气体的质量之比是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com