
分析 反应3Cl2+8NH3=6NH4Cl+N2中,Cl元素化合价由0价降低到-1价,被还原,Cl2为氧化剂,N元素化合价由-3价升高到0价,被氧化,NH3为还原剂,结合元素化合价的变化和反应的方程式解答该题.
解答 解:(1)反应3Cl2+8NH3=6NH4Cl+N2中,Cl元素化合价由0价降低到-1价,被还原,Cl2为氧化剂,N元素化合价由-3价升高到0价,被氧化,NH3为还原剂,
故答案为:Cl2;NH3;
(2)由方程式可知,当有3molCl2参加反应时,有2molNH3被氧化,则氧化剂和还原剂的物质的量之比等于分子个数比,均为3:2,
故答案为:3:2;
(3)当有68g NH3参加反应时,n(NH3)=$\frac{68g}{17g/mol}$=4mol,其中有$\frac{1}{4}$的氨气被氧化,被氧化的氨气为4mol×$\frac{1}{4}$×17g/mol=17g,故答案为:17.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
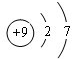 ,C2-的电子式
,C2-的电子式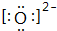 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化亚铁被氧化:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| B. | 铝与稀硝酸反应:2Al+6H+═2Al3++3H2↑ | |
| C. | 过氧化钠和水反应:2Na2O2+2H2O═4Na++4OH-+H2↑ | |
| D. | 向硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度一定时,一个给定的化学反应的平衡常数是一个常数 | |
| B. | 改变反应物浓度或生成物浓度会改变平衡常数 | |
| C. | 温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数 | |
| D. | 浓度Qc<K时,反应向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火可用水扑灭 | |
| B. | 钠可从硫酸镁溶液中置换出大量的镁 | |
| C. | 自然界可存在少量的钠单质 | |
| D. | 金属钠长期置于空气中,最终变成Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A、C两点的正反应速率的关系为A>C | |
| B. | A、B、C、D、E各状态中,v(正)<v(逆)的是状态E | |
| C. | 维持P1不变,E→A所需时间为x;维持P2不变,D→C所需时间为y,则x<y | |
| D. | 使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从P1突然加压至P2,再由P2无限缓慢降压至P1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com