开发新能源,使用清洁燃料,可以达到提高能效、减少污染的目的.
(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲和乙分别是______.
乙是一种清洁燃料,工业上可用甲和氢气反应制得.
①T
1温度时,在体积为2L的密闭容器中充入2mol甲和6mol H
2,反应达到平衡后,测得c(甲)=0.2mol/L,则乙在平衡混合物中的物质的量分数是______.
②升高温度到T
2时,反应的平衡常数为1,下列措施可以提高甲的转化率的是______(填字母).
A.加入2mol甲 B.充入氮气 C.分离出乙 D.升高温度
(2)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染.
已知:
CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(l)△H
1=-890.3kJ/mol
2CO (g)+O
2(g)=2CO
2(g)△H
2=-566.0kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的______倍(计算结果保留1位小数).
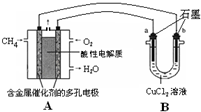
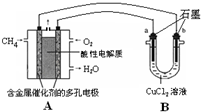
(3)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是______.
②当线路中有0.1mol电子通过时,______(填“a”或“b”)极增重______g.



 (2013?焦作一模)开发新能源,使用清洁燃料,可以达到提高能效、减少污染的目的.
(2013?焦作一模)开发新能源,使用清洁燃料,可以达到提高能效、减少污染的目的.