

| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与N连接,正极反应式是4OH--4e-═2H2O+O2↑ | |
| C. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| D. | 若电键K与M连接,当两极共产生22.4L(标准状况)气体时,生成了1mol NaOH |
分析 若电键K与N连接,该装置没有外接电源,所以构成了原电池;组成原电池时,较活泼的金属铁作负极,负极上铁失电子发生氧化反应;石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应;
若电键K与M连接,该装置是电解池,碳作阳极,铁作阴极,阳极上氯离子放电,阴极上氢离子放电.
解答 解:A、若电键K与N连接,该装置构成了原电池,较活泼的金属铁作负极,Fe被腐蚀,故A错误;
B、若电键K与N连接,该装置构成了原电池,不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,故B错误;
C.若电键K与M连接,构成电解池,将石墨棒换成铜棒,是电解池的阳极,铁棒是阴极,电解质溶液换成CuSO4溶液就可以实现铁棒上镀铜,如果电解质溶液仍然是氯化钠溶液,不能实现铁棒上镀铜,故C错误;
D.若电键K与M连接,该装置是电解池,电池反应式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2 ↑,假设只发生2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2 ↑,根据方程式知,当两极共产生28 L(标准状况)体时,生成了1.25molNaOH,实际上氯化钠只有1mol,与实际不符合,则电解过程中还电解水,所以当氯化钠完全解时,根据原子守恒生成的氢氧化钠是1mol,故D正确;
故选D.
点评 本题考查原电池和电解池原理,明确电极上发生的反应是解本题关键,注意电解池中阳极如果是活泼电极发生的电极反应,为易错点,题目难度中等.


科目:高中化学 来源: 题型:解答题
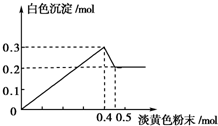 有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如如图所示.(已知:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O).
有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4mol淡黄色粉末时,产生气体0.3mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如如图所示.(已知:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维是信息社会必不可少的有机合成材料 | |
| B. | 食盐加碘实质是在食盐中加入KIO3 | |
| C. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 | |
| D. | 焚烧垃圾会产生大量污染空气的物质,故不宜采用此法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
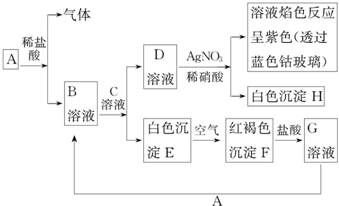
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol
在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4滴入NaAlO2溶液中 | B. | Ba(OH)2溶液滴入Al2(SO4)3溶液中 | ||
| C. | Al2(SO4)3溶液滴入NaOH溶液中 | D. | 氨水滴入Al2(SO4)3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
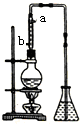 分液.
分液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| N-N | N═N | N≡N | N-H | H-H |
| 193 KJ/mol | 418KJ/mol | 946KJ/mol | 391KJ/mol | 436KJ/mol |
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图2表示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com