
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
 Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色.
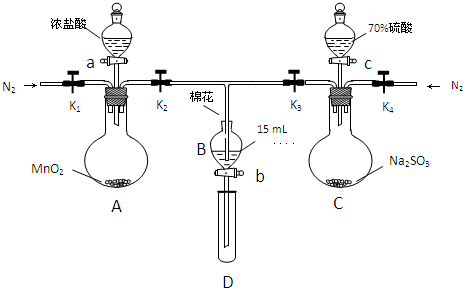
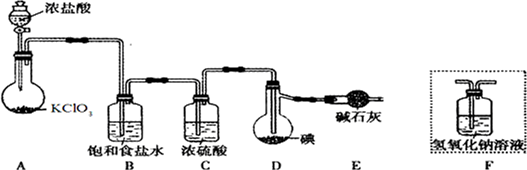
HSO32-+OH-逆向进行,溶液变为浅绿色. 分析 A装置为制取氯气的装置,B装置为氯气氧化亚铁离子的装置,B中盛放氯化亚铁溶液,C装置制备二氧化硫.
(1)装置中存在氧气,会氧化亚铁离子,在溶液中可以氧化二氧化碳;
(2)Cl2、SO2有毒污染空气,应有尾气处理;
(3)浓盐酸与二氧化锰再加热条件下反应生成氯化锰、氯气与水;
(4)浓硫酸溶液中溶质主要以硫酸分子形成存在,电离出的氢离子少浓度低;
(5)用稀盐酸酸化,再用氯化钡溶液检验;
(6)氧化还原反应中氧化剂的氧化性强于氧化产物,也强于还原剂的氧化性;
甲.B可能有存在溶解的氯气氧化SO2;
乙.B中存在Fe3+、Fe2+,说明Cl2氧化性强于Fe3+,且没有Cl2剩余,后有SO42-能说明Fe3+氧化性强于SO2;丙.B中存在Fe3+,说明Cl2氧化性强于Fe3+,后生成了Fe2+,只能是Fe3+被SO2还原;
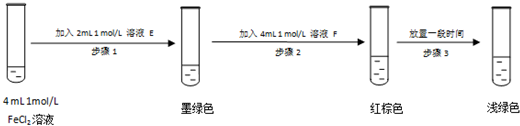
(7)根据假设和实验应先生成FeSO3,再和FeCl3混合,所以分别加入 Na2SO3溶液、FeCl3溶液,溶液变为浅绿色说明生成了Fe2+,即2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,促使Fe3++3H2O  Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色.
HSO32-+OH-逆向进行,溶液变为浅绿色.
解答 解:(1)装置中存在氧气,会对实验结果产生影响,故先排尽装置中的空气,
故答案为:排出装置中的氧气;
(2)Cl2、SO2有毒污染空气,应有尾气处理,装置中的棉花需要浸润强碱溶液吸收Cl2、SO2,
故答案为:氢氧化钠溶液;
(3)制备氯气的反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(4)反应速率的影响因素有温度、浓度、催化剂、接触面积等,题中只有浓度不同,浓硫酸溶液中溶质主要以硫酸分子形成存在,电离出的氢离子少浓度低,70%的硫酸中的H+的浓度比98%的硫酸中的H+的浓度大,反应速率快,
故答案为:70%的硫酸中的H+的浓度比98%的硫酸中的H+的浓度大;
(5)检验B溶液中是否含有硫酸根的操作是:取少量B溶液于试管中,加入足量的稀盐酸酸化,在滴加几滴氯化钡溶液,若有白色沉淀生成,证明溶液B中有硫酸根,
故答案为:取少量B溶液于试管中,加入足量的稀盐酸酸化,在滴加几滴氯化钡溶液,若有白色沉淀生成,证明溶液B中有硫酸根;
(6)理论依据是氧化还原反应中氧化剂的氧化性强于氧化产物,也强于还原剂的氧化性;
甲.B可能有存在溶解的氯气氧化SO2,故错误;
乙.B中存在Fe3+、Fe2+,说明Cl2氧化性强于Fe3+,且没有Cl2剩余,故后有SO42-能说明Fe3+氧化性强于SO2,故正确;
丙.B中存在Fe3+,说明Cl2氧化性强于Fe3+,后生成了Fe2+,只能是Fe3+被SO2还原,故正确.‘
故选:乙丙;
(7)根据假设和实验应先生成FeSO3,再和FeCl3混合,所以分别加入 Na2SO3溶液、FeCl3溶液;溶液变为浅绿色说明生成了Fe2+,即2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,促使Fe3++3H2O  Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色,
HSO32-+OH-逆向进行,溶液变为浅绿色,
故答案为:Na2SO3溶液;FeCl3溶液;反应2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,促使Fe3++3H2O  Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色.
HSO32-+OH-逆向进行,溶液变为浅绿色.
点评 本题是综合化学实验题,考查实验的具体操作步骤、操作目的、原理、微粒的检验及分析等有关问题,有利于培养学生的分析推理、思维缜密等,是对学生综合能力的考查,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
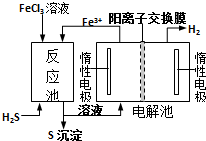 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液,吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液,吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中正确的是( )| A. | 电解池中OH-从右槽迁移到左槽 | |
| B. | H+在右槽发生氧化反应 | |
| C. | 左槽中发生的反应是:4OH--4e-═O2↑+2H2O | |
| D. | 常温常压下,反应中每转移1mol电子生成1g氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>Al | |
| B. | 若把铝钠合金投入一定量的水中只得到无色溶液,则n(Al)≤n(Na) | |
| C. | m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com