
【题目】下列实验操作对应的现象不符合事实的是
选项 | 实验操作 | 现象 |
A | 向盛有 | 溶液逐渐变为黄色,滴加KSCN后溶液变血红色 |
B | 向盛有 | 溶液逐渐褪色,静置后观察到溶液有分层现象 |
C | 向 | 先产生白色沉淀,后沉淀消失 |
D | 向盛有 | 有刺激性气味气体产生,溶液变浑浊 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。
![]()
已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
Ⅱ.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是______________。
(2)吸收塔中的原料B可以选用_____________(填字母序号)。
A.NaCl溶液 B.Na2CO3溶液 C.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。

①A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是_____________。装置B的作用是______________。
②C中制备Na2S2O3发生的连续反应有:Na2S+H2O+SO2=Na2SO3+H2S_____________和Na2SO3+S![]() Na2S2O3 。
Na2S2O3 。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用图示装置制备高铁酸钾(K2FeO4)并探究其性质。已知:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。制取实验完成后,取C中紫色溶液,加入稀盐酸,产生气体。下列说法不正确的是

A.B瓶应盛放饱和食盐水除去混有的HCl
B.C瓶中KOH过量更有利于高铁酸钾的生成
C.加盐酸产生气体可说明氧化性:K2FeO4>Cl2
D.高铁酸钾是集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等八大特点为一体的优良的水处理剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质。其转化过程如下:
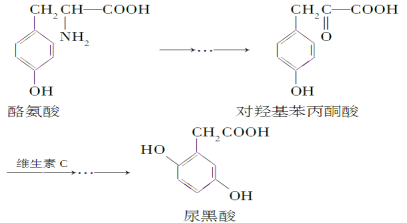
下列说法错误的是( )
A.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
B.1mol尿黑酸与足量NaHCO3反应,最多消耗3molNaHCO3
C.酪氨酸既能与盐酸反应,又能与氢氧化钠反应
D.1mol尿黑酸与足量浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和实验结论均正确且前后相匹配的是
选项 | 实验操作 | 现象 | 结论 |
A | 向含等物质的量浓度的 | 先生成黑色沉淀,静置,继续滴加 |
|
B | 向蔗糖溶液中加入稀硫酸并水浴加热,一段时间后再向混合液中加入新制备的 | 无砖红色沉淀产生 | 蔗糖未水解 |
C | 向氯水中滴加紫色石蕊试液 | 溶液变为红色,且长时间内颜色无变化 | 氯水显酸性 |
D | 将少量硼酸溶液滴入碳酸钠溶液中 | 无气泡产生 | 酸性: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室探究过渡金属元素化合物的性质
(1)向![]() 溶液中滴加NaOH溶液,产生白色沉淀,但迅速变为灰绿色,最终变为红褐色,为顺利看到较长时间的白色沉淀,设计了如图装置:①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K。以上操作正确的顺序是:________。
溶液中滴加NaOH溶液,产生白色沉淀,但迅速变为灰绿色,最终变为红褐色,为顺利看到较长时间的白色沉淀,设计了如图装置:①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K。以上操作正确的顺序是:________。

(2)某实验小组称量![]() 草酸亚铁晶体
草酸亚铁晶体![]() 加热过程中,固体质量变化如图所示:
加热过程中,固体质量变化如图所示:
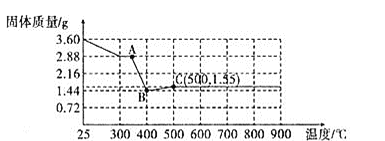
①请写出AB段发生反应的化学方程式:________________。
②![]() 点成分为:________。
点成分为:________。
(3)向![]() 溶液中加入过量
溶液中加入过量![]() 溶液,设计实验证明两者发生了氧化还原反应并且为可逆反应。
溶液,设计实验证明两者发生了氧化还原反应并且为可逆反应。![]() 简要说明实验步骤、现象和结论,仪器和药品自选
简要说明实验步骤、现象和结论,仪器和药品自选![]() ________________。
________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置用环己醇制备环己烯,装置如图1所示。

已知: +H2O。
+H2O。
密度/ g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①试管A中碎瓷片的作用是___,导管B除了导气外还具有的作用是__。
②将试管C置于冰水中的目的是__。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在___(填“上”或“下”)层,分液后用___(填字母)洗涤。
a.酸性KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将提纯后的环己烯按如图2所示装置进行蒸馏,冷却水从__(填字母)口进入,目的是___。蒸馏时要加入生石灰,目的是___。

③收集产品时,应控制温度在___左右,实验制得的环己烯精品质量低于理论产量,可能的原因是___(填字母)。
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗产品时环己醇随产品一起蒸出
(3)以下用来区分环己烯精品和粗品的试剂或方法中,合理的是__(填字母)。
a.酸性高锰酸钾溶液 b.金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。

请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:____________________________________。
(2)向乙中加入几滴酚酞溶液,工作一段时间后铁电极附近溶液变红,请用化学用语解释相关原因__________________________________
(3)若在标准状况下,有4.48 L氧气参加反应,则乙装置中C电极上生成的气体的物质的量为__________。
(4)欲用丙装置给铜镀银,b应是____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素。A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能。E是第四期第IB族元素,回答下列问题:
A | B | |
D |
⑴E原子的基态电子排布式 ______;
⑵A、B、C三种元素的第I电离能由大到小的顺序是 ______;
⑶D能形成多种价态的含氧酸,其酸性由强到弱的顺序为 ______;
⑷已知金属C单质的晶胞为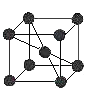 ,则C原子的堆积方式为 ______ ,C原子的配位数是 ______ ;
,则C原子的堆积方式为 ______ ,C原子的配位数是 ______ ;
⑸向E、D形成的稳定化合物溶液中不断加入A的常见氢化物水溶液,最后E的最主要存在形式为![]() 写真实符号
写真实符号![]() ______。
______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com