
(10分 )工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
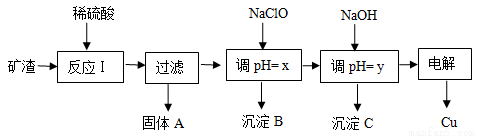
已知: Cu2O + 2H+ = Cu + Cu2+ + H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)反应I中如果Cu2O与Fe2O3之间恰好发生氧化还原反应,则反应的化学方程式为:___________________________________________________________________________
(2)用NaClO调pH=x是此工艺流程中的最佳选择。
①选择NaClO的理由是:____________________________________________________
②生成沉淀B的同时生成一种具有漂白作用的物质,写出该反应的离子方程式为:
_________________________________________________________________________
(3)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol·L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,则溶液的pH为 ____。(已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20)
(4)电解初期阳极的电极反应式为________________________________
(10分,每空2分)
(1)Cu2O + Fe2O3 + 4H2SO4= 2CuSO4 + 2FeSO4 + 4H2O
(2)①NaClO由于发生反应ClO-+ H+ HClO,ClO-消耗了H+,ClO-又具有氧化性,可将Fe2+氧化成Fe3+。所以最好用NaClO调节pH。
HClO,ClO-消耗了H+,ClO-又具有氧化性,可将Fe2+氧化成Fe3+。所以最好用NaClO调节pH。
②5ClO-+ 2Fe2+ + 5H2O = 2Fe(OH)3 + Cl-+ 4HClO
(或 2Fe2+ +7ClO-+ 2H++ 5H2O = 2Fe(OH)3 + Cl-+ 6HClO)
(3)6 (4)2Cl-- 2e- = Cl2↑
【解析】
试题分析:(1)Cu2O与Fe2O3之间恰好发生氧化还原反应,+3价的Fe把+1价的Cu氧化为+2价,根据化合价升降法配平可得化学方程式:Cu2O + Fe2O3 + 4H2SO4= 2CuSO4 + 2FeSO4 + 4H2O
(2)①ClO?能与H+反应:ClO-+ H+ HClO,消耗了H+,ClO-又具有氧化性,可将Fe2+氧化成Fe3+,所以最好用NaClO调节pH。
HClO,消耗了H+,ClO-又具有氧化性,可将Fe2+氧化成Fe3+,所以最好用NaClO调节pH。
②NaClO有氧化性,Fe2+有还原性。所以用NaClO调节pH,生成沉淀B为Fe(OH)3,同时生成一种具有漂白作用的物质为HClO,该反应的离子方程式为5ClO-+ 2Fe2+ + 5H2O = 2Fe(OH)3 + Cl-+ 4HClO或2Fe2++7ClO-+2H++5H2O=2Fe(OH)3↓+Cl-+6HClO。
(3)溶液中Cu2+浓度降至原来的百分之一,为2×10-4mol?L?1,根据c(Cu2+)?c2(OH?)==2×10-20,解得c(OH?)=1×10、8mol/L,则pH=6。
(4)电解初期阳极上Cl?失电子,所以电极反应式为:2Cl-- 2e- = Cl2↑
考点:本题考查化学流程的分析、方程式的书写、溶度积的计算、电解原理。


科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
根据表中信息判断,下列选项不正确的是
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.中子数为20的氯原子:
B.NH3分子的电子式:
C.铝原子的结构示意图: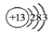
D.聚丙烯的结构简式为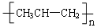
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
在淀粉—碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是
A.氧化性:ClO->I2>SO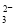 B.漂白粉溶液可使淀粉碘化钾试纸变蓝
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.次氯酸钠可以与亚硫酸钠共存 D.向氯水中加入亚硫酸钠溶液,氯水褪色
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
下列变化能够实现的是:①复分解反应中既没有生成水,也没有生成沉淀和气体;②两种氧化物发生反应有气体生成;③两种酸的溶液充分反应后溶液呈中性;④弱酸与盐溶液反应生成强酸。
A.只有①③ B.只有②④ C.只有①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:选择题
24 mL 0.05 mol/L的 Na2SO3恰好与20 mL 0.02 mol/L的K2R2O7溶液完全反应,则R元素在还原产物中的化合价为( )
A.0 B.+2 C.+3 D.+6
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.在一定条件下,催化分解80 g SO3所得混合气体中氧原子数为3NA
B.一定条件下,铁与水蒸气反应生成8.96 L(已折合成标准状况)H2时,转移的电子数为0.8NA
C.将100 mL 1 mol/L AlCl3与100 mL 3 mol/L NaCl溶液混合后,Cl-的个数为0.6NA
D.含有非极性键的数目为NA的Na2O2与水充分反应产生标准状况下22.4 L O2
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三9月第二次阶段考化学试卷(解析版) 题型:实验题
(13分)实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。

(1)为了安全,在点燃D处的酒精灯之前,在b出口处必须_________________________。
(2)装置B的作用是_ ______________;装置C中装的液体是_______,所起的作用是______。
(3)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生反应的化学方程式是________________________________________。
(4)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后U型管的质量增加7.2g,则混合物中Fe2O3的质量为___________g。
(5)U形管E右边又接连干燥管F的目的是____,若无干燥管F,测得Fe2O3的质量将_____(填“偏大”“偏小”或“无影响”)。
(6)若反应后得到的残留固体中还有少量FeO,测得的Fe2O3质量将______(填“偏大“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com