
| A. | 铝粉与盐酸反应 | B. | 浓硫酸溶于水 | ||
| C. | 碳酸钙受热分解 | D. | NH4Cl与Ba(OH)2•8H2O反应 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:A、金属和酸的反应为放热反应,故铝粉和盐酸的反应放热,故A正确;
B、浓硫酸溶于水不是反应,只是放热的物理过程,故B错误;
C、绝大多数的分解反应为吸热反应,故碳酸钙的分解为吸热反应,故C错误;
D、铵盐和碱的反应吸热,故NH4Cl与Ba(OH)2•8H2O的反应为吸热反应,故D错误.
故选A.
点评 本题考查放热反应,难度不大,掌握中学化学中常见的吸热或放热的反应是解题的关键.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①③⑦ | C. | ①⑥⑦ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:ClO->I2>SO42- | |
| B. | 蓝色消失的原因是Na2SO3溶液反应生成SO2具有漂白性 | |
| C. | 淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2遇淀粉变蓝 | |
| D. | 若将Na2SO3溶液加入溴水,溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
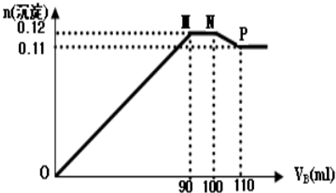
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
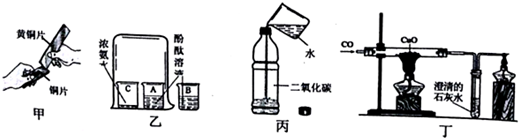
| A. | 甲实验中黄铜片能在铜片上刻画出痕迹可以说明黄铜的硬度比铜片大 | |
| B. | 乙实验既可以说明分子在不停的运动着,又可以说明氨水显碱性 | |
| C. | 丙实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性 | |
| D. | 丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
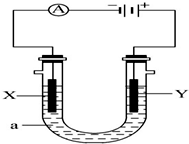 电解原理在化学工业中有广泛应用.如图表示一个电解池,X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com