
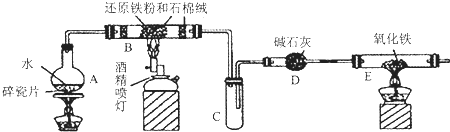
分析 由题目的信息可知:铁与水蒸气在高温的条件下生成四氧化三铁和氢气,配平即可;装置C中右侧导管为什么既不插入试管底部,又不进入试管一点点,其主要原因是:B中有氢气产生,为将C中原空气赶尽,C中右侧导管不能太短,而A中产生水蒸气在B中不能完全反应,将凝结成水聚集在试管底部,为能使氢气顺利通入D、E,C中右侧导管又不能太长.实验过程中最后点燃的是:E处酒精灯,可以防止爆炸;装置E中的现象是:固体粉末由红变黑,试管壁上有水雾;
(1)根据铁与水在高温下反应产生一种单质气体和一种黑色的金属氧化物,这种金属氧化物与铁在氧气中燃烧的产物是同一物质,铁在氧气中燃烧的产物是Fe3O4,根据元素守恒,单质气体为H2,圆底烧瓶中盛装的是水,该装置受热后的主要作用 提供水蒸气;
(2)碱石灰作用是吸收氢气中的水蒸气;
(3)考虑实验的安全性,不纯氢气点燃可能会爆炸;应使整个装置中充满氢气后再点燃E处酒精灯;
(4)E中是氢气还原氧化铁,氧化铁为红色,还原出的铁为黑色(纯铁为银白色).
解答 解:(1)圆底烧瓶中盛装的是水,该装置受热后的主要作用提供水蒸气,铁与水蒸气在高温的条件下生成四氧化三铁和氢气,配平得到化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
故答案为:提供水蒸气,3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)生成的氢气中含有水蒸气,通入装置E前需要除去水蒸气,气体通过碱石灰干燥后得到干燥的氢气还原氧化铁,故答案为:吸收水蒸气;
(3)实验过程中最后点燃的是:E处酒精灯,可以防止爆炸,故答案为:③;
(4)氢气和氧化铁在加热的条件下生成铁和水,装置E中的现象是:固体粉末由红色变黑色,试管壁上有水雾,
故答案为:固体粉末由红色变黑色,试管壁上有水雾.
点评 本考点既考查了实验步骤的设计,又考查了化学方程式的书写,还对实验进行了评价,综合性比较强.实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验资料和实验分析,得到了正确的结论,属于结论性探究.题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | SiC中硅元素的化合价为-4价,SiC属于共价化合物 | |
| B. | 标准状况下,22.4LCCl4中所含共价键数目为4NA | |
| C. | 该反应中CCl4是还原剂 | |
| D. | 每转移8mol电子,会生成1molSiC |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 8:7 | B. | 2:7 | C. | 1:1 | D. | 1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 常温常压下,32gO2和32gO3所含氧原子数都是NA | |
| C. | 1molFe与足量盐酸反应,转移电子数为3NA | |
| D. | 标准状况下36g H2O中原子的数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol/L的H2A溶液 | |
| B. | 0.01 mol/L的NaHA溶液 | |
| C. | 0.02 mo|/L的NaOH溶液与0.02 mol/L的NaHA溶液等体积混合 | |
| D. | 0.02 mol/L的HCl溶液与0.04 mol/L的NaHA溶液等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌片发生氧化反应 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 铜片反应式为Cu2++2e-═Cu | D. | 该电池的反应本质是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com