
 为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验.
为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验.| 间/min | 现象 |
| 0~15 | 铜表面出现气泡,但速度很慢 |
| 25 | 溶液有很浅的蓝色,气泡生成速度加快 |
| 30 | 气泡生成速度较快,均匀冒出 |
| 45 | 洗气瓶中可见少量淡棕色的物质 |
| 50 | 溶液中蓝色明显变深,洗气瓶中突显明显棕色 |
| 序号 | 温度 | 铜片/g | 硝酸/mL | 硝酸铜/g |
| 1 | 25℃ | ① | ② | ③ |
| 2 | 25℃ | 5 | 20 | 0.5 |
| 3 | 25℃ | 5 | 20 | 1.0 |


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
| A、32 g氧气和臭氧的混合气体中所含的原子数为2NA |
| B、常温常压下,22.4LCO2含有的分子数目为NA |
| C、标准状况下,22.4 LCCl4中含有的碳原子数目为NA |
| D、78gNa2O2与足量的水反应转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
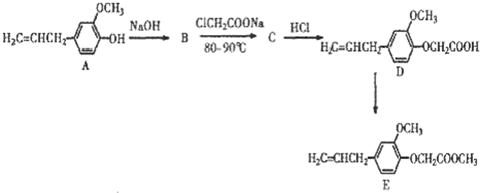
查看答案和解析>>
科目:高中化学 来源: 题型:
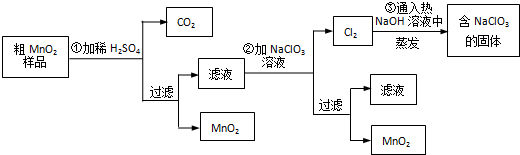
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图Ⅰ可表示对于达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 |
| B、图Ⅱ可表示体积都为1L,pH=2的盐酸和醋酸溶液分别与0.65g锌粒反应生成氢气速率的快慢 |
| C、图Ⅲ表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、p1<p2 |
| D、图Ⅳ可表示将等体积pH=2的盐酸和醋酸分别加水稀释过程中pH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯水和干木头都不导电,但木头用水浸湿后可以导电 |
| B、盛放碳酸钠溶液的试剂瓶不能用玻璃塞 |
| C、草木灰不能和铵态氮肥混合使用 |
| D、寻找高效催化剂,使水分解出产物氢气,同时释放能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)>c(F-) |
| B、c(H+)>c(HF) |
| C、c(H+)>c(OH-) |
| D、c(HF)>c(F-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com