
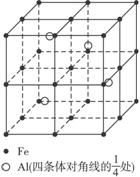
(1)确定该合金的化学式_____________。
(2)若晶体的密度为ρ g·cm-3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为_____________cm。
(3)取该合金粉末2.78 g溶于100 mL某稀硝酸溶液中,待反应完全后得到1.12 L(标准状况)NO气体(设两者恰好完全反应),则原硝酸溶液的物质的量浓度为__________ mol·L-1,反应后溶液中Fe3+离子的物质的量浓度为_____________mol·L-1(假定溶液体积变化忽略不计)。
(1)Fe2Al
(2)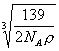
(3)2 0.1
解析:(1)晶胞内Al共4个。
Fe 8×![]() +6×
+6×![]() +12×
+12×![]() +1
+1
↓ ↓ ↓ ↓
顶点 面心 棱上 体心
=8
故化学式为Fe2Al。
(2)一个晶胞含4个Fe2Al。
令距离为a,则有:
(2a)3×![]() ×Na×ρ=139
×Na×ρ=139
a=
(3)2.78 g中有0.02 mol Fe2Al,即0.04 mol Fe和0.02 mol Al。
1.12 L NO![]() 0.05 mol×3e-=0.15 mol e-
0.05 mol×3e-=0.15 mol e-
则共耗HNO3为0.05 mol+0.15 mol=0.20 mol
其浓度为2 mol·L-1。
0.15 mol e-中Al提供0.06 mol其余0.09 mol为Fe提供,则Fe3+为0.01 mol,
Fe2+为0.03 mol,
故c(Fe3+)=0.1 mol·L-1。
此题综合性强,考查了氧化还原反应的典型计算和立体几何化学知识。学生可能(2)问有较大问题,(3)的第一问走弯路。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:阅读理解
(12分)晶体的最小重复单位是晶胞,晶胞一般为平行六面体。NaCl属立方面心晶格,在NaCl晶胞中8个顶点各有一个Na+,6个面心处各有一个Na+,故我们说Na+形成立方面心晶格,而在该晶胞的12条棱的中点处各有一个Cl-,在该立方晶胞的体心处还有一个Cl-,故Cl-也形成立方面心晶格。
1.KCl和NaCl的晶格型式相同。已知Na+离子的半径是Cl-离子的0.5倍,而又是K+离子的0.7倍,计算:KCl晶胞和NaCl晶胞的边长之比;KCl和NaCl晶体的密度之比。
2.将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在每两个不共面的“小立方体”中心处各放置一个C原子便构成了金刚石的一个晶胞,则一个金刚石的晶胞中有_______个C原子。并计算金刚石的密度。(已知C原子的半径为7.7×10-11m)
3.白硅石SiO2属AB2型共价键晶体。若将金刚石晶胞中的所有C原子换成Si原子,同时在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,则构成SiO2晶胞,故SiO2晶胞中有____个Si原子,____个O原子,离O原子最近的Si原子有____个,离Si原子最近的O原子有____个。
4.干冰(固态CO2)属于分子晶体。若把每个CO2分子抽象为一个质点(微粒),则其晶胞也属于立方面心晶格,故一个干冰晶胞中有_____个CO2,与1个CO2分子最近的CO2分子有_____个;在干冰分子中,原子之间靠______结合,CO2分子之间靠______结合。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com