
某小组对Cu与浓HNO3的反应进行研究。记录如下: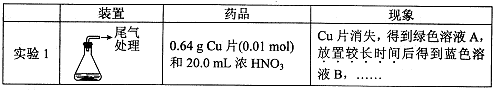
I.Cu与浓HN03反应的化学方程式是 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是 。
(2)乙认为溶液呈绿色是由溶解的NO2引起的。进行实验2:先将NO2通入B中,再鼓入N2。结果证实假设成立。则以上两步操作对应的现象分别是 、 。
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O =HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.NO—2能与Cu2+反应:Cu2+(蓝色)+4 NO2- Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2—4使溶液呈绿色。
丙进行如下实验:
①亚硝酸分解的化学方程式是 。
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因: 。
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是 ,请依据实验现象阐述理由: 。
Ⅰ、Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O (2分)
Ⅱ、(1)溶液A和溶液B中,c(Cu2+)基本相同; (2分)
(2)溶液由蓝变绿,(1分) 溶液由绿变蓝, (1分) 有红棕色气体逸出 (1分)
(3)①3 HNO2= HNO3+2NO↑+H2O (2分)
②加入稀硫酸 ,抑制HNO2的电离,并使HNO2分解,降低c(NO2-),造成Cu2++4 NO2- Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色; (2分)
Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色; (2分)
(4)A中剩余浓硝酸溶解了NO2得到黄色溶液与Cu(NO3)2蓝色溶液混合而形成的绿色;(2分)
实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中NO2-不能大量存在,因此,A溶液中绿色的Cu(NO2)42-不能大量存在,Cu2+和NO2-反应生成Cu(NO2)42-不是使溶液呈绿色的主要原因。(2分)
解析试题分析:Ⅰ、Cu与浓HN03反应的化学方程式是Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O;
Ⅱ、(1)铜片完全溶解后,溶液A和溶液B中,c(Cu2+)基本相同;
(2)乙认为溶液呈绿色是由溶解的NO2引起的,当将NO2通入B中时溶液应由蓝变绿,再通入氮气,红棕色二氧化氮气体逸出,溶液又由绿变回蓝色;
(3)①HNO2中氮元素为+3价,分解时应发生歧化反应,化学方程式为3HNO2=HNO3+2NO↑+H2O
②从化学平衡移动角度分析。HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。加入稀硫酸 ,抑制HNO2的电离,并促使HNO2分解,降低c(NO2-),造成Cu2++4 NO2- Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色;
Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色;
(4)由实验3得溶液呈绿色的主要原因是A中剩余浓硝酸溶解了NO2得到黄色溶液与Cu(NO3)2蓝色溶液混合而形成的绿色;实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中NO2-不能大量存在,因此,A溶液中绿色的Cu(NO2)42-不能大量存在,Cu2+和NO2-反应生成Cu(NO2)42-不是使溶液呈绿色的主要原因。
考点:考查化学方程式的书写,对实验现象的分析,平衡理论的应用


科目:高中化学 来源: 题型:实验题
实验室可以用如下方法制取少量单质溴:
2NaBr+MnO2+2H2SO4 Na2SO4+MnSO4+Br2↑+2H2O
Na2SO4+MnSO4+Br2↑+2H2O
根据左图实验装置,填空和回答问题: 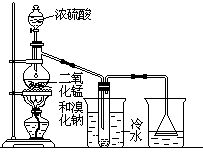
(1)装置(Ⅰ)的烧杯中冷水所起的作用是______ ,装置(Ⅱ)的烧杯中液体的作用是 ______________。
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为 ____________________________。
(3)装置(Ⅱ)烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
如图是一个制取氯气并以氯气为原料进行特定反应的装置。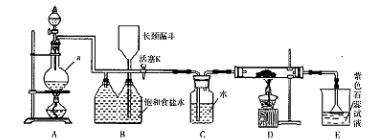
(l)A是氯气发生装置,写出其中的化学反应方程式 。
(2)a仪器的名称为 。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式 ,装置C的作用是 。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为 。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为 (填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2
产生,则装置B中的现象是 ;若发现装置B中该现象不明显,可能的
原因是 ;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸
有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程
式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式 。
(2)装置C中的试剂是 ;装置F的作用是 ;
装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式: 。
②滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
③滴定前检验Fe3+是否被完全还原的实验操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用下述装置制取氯气,并用氯气进行下列实验。 回答下列问题: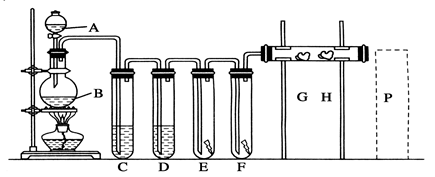
(1)A、B两仪器的名称:A_________________,B________________。
(2)洗气装置C是为了除去Cl2中的HCl气体,应放入的试剂是________________,D中浓H2SO4的作用是________________。
(3)E中为红色干布条,F中为红色湿布条,可看到有色布条褪色的是 _______。(填E或F)
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成______________。
H是浸有NaBr溶液的棉花球,H处反应的离子方程式是___________________________________________。
(5)P处为尾气吸收装置, 写出实验室利用烧碱溶液吸取Cl2的离子方程式: ___________________。
(6)B中发生反应的化学方程式为_______________________ ,若实验中使用12 mol·L-1的浓盐酸10 mL与足量的二氧化锰反应, 实际生成的Cl2的物质的量总是小于0.03 mol,试分析可能存在的原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。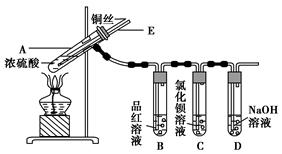
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为 。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是 。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组在实验室探究氨的有关性质,设计了下图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取.
①碳酸钠 ②碳酸氢钠 ③碳酸氢铵 ④氯化铵 ⑤熟石灰 ⑥氢氧化钠
按上图连接好各仪器,现将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯,部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解,回答下列问题:
(1)若A中制取气体时只用了一种药品,则该药品是 (填物质序号)
(2)B装置的作用为
(3)D中铜片发生反应的离子方程式为 ,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的 (填下列各项序号)
| A.Na2CO3 | B.AgNO3 | C.H2SO4 | D.FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)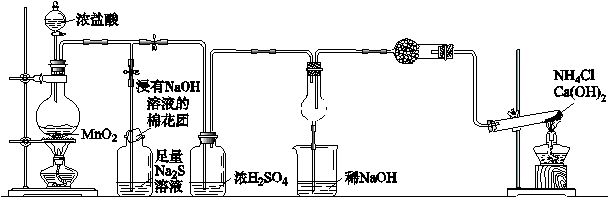
A B C D E
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫的原因 。
(4)D中干燥管中出现的现象及化学方程式 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请画出其装置图 (并注明盛装试剂)。
(6)还有什么方法能证明氧化性Cl2 > S,用一种相关事实说明 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计的制备Na2S2O3·5H2O的装置和部分操作步骤如下。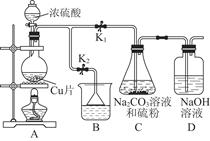
Ⅰ.打开K1关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
Ⅱ.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热。
Ⅲ.过滤C中的混合液。
Ⅳ.将滤液经过 、 、过滤、洗涤、烘干,得到产品Na2S2O3·5H2O。
①Ⅱ中,“当C中溶液的pH接近7时即停止C中的反应”的原因是 (用离子方程式表示)。
②Ⅳ中,操作步骤是 、 。
③装置B中盛放的试剂是(填化学式) 溶液。
④有一小组在实验中发现,二氧化硫气体产生缓慢以致后续现象不明显,但又不存在气密性问题,请你推测可能的原因 。
(2)常用Na2S2O3溶液测定废水中Ba2+的浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.001 0 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准 | | | | |
| 溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com