
|
在25℃时将两个不溶性电极插入一定量的硫酸钠饱和溶液中进行电解,电解一段时间后,阴阳极两极共逸出3a摩气体,同时有W克十水硫酸钠晶体析出,若温度不变,则原溶液中溶质的质量分数为 | |
| [ ] | |
A. |
W/(W+54a)×100% |
B. |
71W/161(W+36a)×100% |
C. |
W/(W+36a)×100% |
D. |
71W/161(W+54a)×100% |
科目:高中化学 来源: 题型:阅读理解
 (2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
(2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
| ||
| ||
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
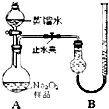 (2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
(2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
查看答案和解析>>
科目:高中化学 来源:2011届福建省宁德市高三普通高中毕业班质量检查(理综)化学部分 题型:实验题
某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究。
[实验一] 取样品0. 100 g,用右图所示实验装置进行测定。
(夹持装置省略)
(1)检查装置A气密性的方法是 。
(2)若在实验过程中共产生气体11.20 mL(已折算成标准
状况),则样品中Na2O2的纯度为 。
[实验二] 样 品溶于水后用盐酸滴定
品溶于水后用盐酸滴定
(3)取一定量样品溶于水并配制成250 mL溶液,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到 。
(4)取上述所配溶液各25.00 mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com