


科目:高中化学 来源: 题型:
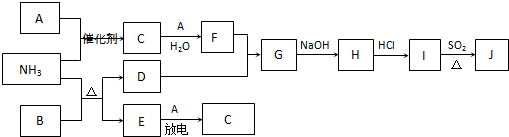
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 通电 |
| 加热 |
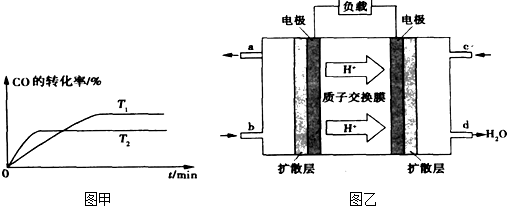
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省湛江市普通高考测试(二)理综化学试卷(解析版) 题型:选择题
下列物质的应用不涉及氧化还原反应的是
A.用稀硝酸洗去附在试管内壁的银镜
B.用热的纯碱溶液清洗油污
C.用新制的氢氧化铜悬浊液与病人的尿液混和加热,来检验病人是否患糖尿病
D.在铁质镀件上镀铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com