
A、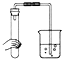 |
B、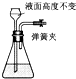 |
C、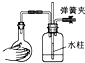 |
D、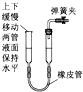 |


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2D | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
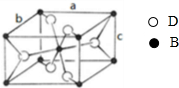 ,该氧化物的化学式为
,该氧化物的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:
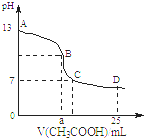 25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )
25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )| A、若B点的横坐标a=12.5,且有c(Na+)=c(CH3COO-) |
| B、对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、D点时,c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D、C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a<b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH<8.0 |
| D、若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-) |
B、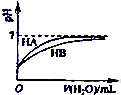 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液PH随加水量的变化,则NaA溶液的PH大于同浓度的NaB溶液的PH |
C、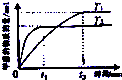 表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是放热反应 |
D、 表示将1.000 mol/L氨水滴入20.00mL1.000 mol/L盐酸中,溶液PH和温度随加入氨水体积变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol?/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、木糖醇与葡萄糖、果糖等一样是一种单糖 |
| B、木糖醇极易溶于水 |
| C、木糖醇是一种五元醇 |
| D、木糖醇是一种无糖型植物甜味剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
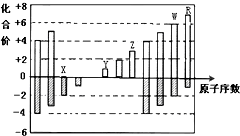
| A、原子半径:Z>Y>X |
| B、气态氢化物的稳定性:W>R |
C、X的一种氢化物具有氧化性,其电子式为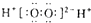 |
| D、Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com