
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )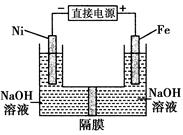
| A.铁是阳极,电极反应为Fe-6e-+4H2O===FeO+8H+ |
| B.镍电极上的电极反应为2H2O+2e-==H2↑+2OH- |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变 |
科目:高中化学 来源: 题型:实验题
某学生在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,整个溶液几乎没有什么变化,但溶液加热后,显明显淡红色,加热较长时间后冷却,红色不褪去。
该学生为了了解该过程的原因,进行了下列探究过程:
【实验探究】
实验1: 加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实不能用电化学原理解释的是( )
| A.镀锌铁片比镀锡铁片更耐腐蚀 |
| B.远洋海轮的尾部装上一定数量的锌板 |
| C.常温条件下,在空气中铝不易被腐蚀 |
| D.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
燃料电池是燃料(如H2、CO、CH4等)跟氧气或空气起反应,将化学能转变为电能的装置,电解液为强碱溶液。下列关于甲烷燃料电池的说法正确的是( )
| A.负极反应为CH4+10OH-→CO32-+7H2O+8e- |
| B.负极反应为O2+2H2O+4e-→4OH- |
| C.随着放电进行,溶液中的阳离子向负极移动 |
| D.随着放电进行,溶液的PH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
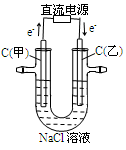
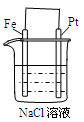
下列说法不正确的是
| A. | B. | C. | D. |
| 通电一段时间后,搅拌均匀,溶液的pH增大 | 甲电极上的电极反应为: 2Cl- -2e- = Cl2↑ | Pt电极上的电极反应为:O2+2H2O+4e-==4OH- | 总反应的离子方程式为: 2Fe3++Cu=Cu2++ 2Fe2+ |
 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关金属铁的腐蚀与防护,说法正确的是
| A.酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.铁与电源正极连接可实现电化学保护 |
| D.将钢管与铜管一起堆放时可保护钢管少受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于锌-铜-稀H2SO4组成的原电池装置中,当导线中有1mol电子通过时理论上的电极变化:
①锌片溶解了32.5g ②锌片增重32.5g ③铜片上析出了1g H2 ④铜片上析出1molH2
| A.①③ | B.①④ | C.②③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关电池的说法不正确的是
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可直接把化学能转化为电能 |
| D.铅蓄电池充电时,阳极的反应为:PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述的方法不正确的是 ( )
| A.金属的电化学腐蚀比化学腐蚀更普遍 |
| B.用铝质铆钉铆接铁板,铁板易被腐蚀 |
| C.钢铁在干燥空气中不易被腐蚀 |
| D.用牺牲锌块的方法来保护船身 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com