
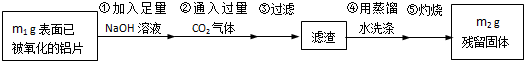
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝和氢氧化钠反应 |
| B、氯化铝溶液中滴加足量氢氧化钠溶液 |
| C、向NaAlO2溶液中通入过量的CO2气体 |
| D、氯化铝溶液中滴加足量的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、②和③ | B、仅有③ |
| C、仅有④ | D、以上都错 |
查看答案和解析>>
科目:高中化学 来源: 题型:
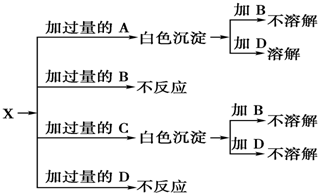
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20% | B、40% |
| C、60% | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
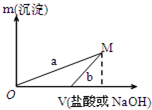 某同学设计了两种方案制备氢氧化铝.
某同学设计了两种方案制备氢氧化铝.| 100mL稀盐酸 |
| NaOH溶液 |
| 100mLNaOH溶液 |
| 稀盐酸 |
| A、a曲线表示的是向X溶液中加入NaOH溶液 |
| B、在M点时,两种方案中所得溶液的溶质质量分数相同 |
| C、方案二比方案一生成更多的气体 |
| D、M点以后,a、b两条曲线将重合为一条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com