
����Ŀ��.��Ч��ˮ���ۺ��Ȼ�������PAFC������ɿɱ�ʾΪ[AlFe(OH)nCl6-n]m�������ʹ㷺Ӧ�����ճ�������ˮ��ҵ��ˮ�Ĵ�����ij�������Թ�ҵ���ϣ��������������������Ϊԭ����ȡPAFC������������̣�

(1)PAFC����Ԫ�صĻ��ϼ�Ϊ_________��
(2)������ϡ�����Ϻ����˶����ѧ��Ӧ���ڷ�������Щ��Ӧ�У���д��һ����������ԭ��Ӧ���������Ĵ������Ӧ���͵ķ�Ӧ�����ӷ���ʽ______________________________��
(3)����������Һ�У�����ȷ���Ƿ�һ�����ڵ���������___________����ȷ�ϸ������Ƿ������õ��Լ�����Ϊ____________________��
(4)�Լ�X����������е�__________
A��Fe B��HNO3 C����ˮ D�����������Һ
(5)ˮ���γɵľۺ����ɢ��ˮ�е�����ֱ����1nm��100nm֮�䣬���ü�ʵ�������֤�÷�ɢϵ ____________________________________________________________________________��
��.Ϊ���PAFC��Al��Fe������������ͼ��ʾ���̽��С�
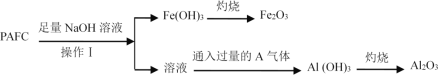
�ش��������⣺
(6)����I������______________________��
(7)ͨ�������A��������ӷ���ʽΪ ______________��
���𰸡� +3 Al+3Fe3+=Al3++3Fe2+ Fe3+ ���軯����Һ C ��һ����ͨ���������Կ���һ�������ġ�ͨ·����������������� ���� AlO2+CO2+2H2O=Al(OH)3��+HCO3
����������1���������ϼ���x���ۺ��Ȼ������ɱ�ʾΪ[AlFe��OH��nCl6-n]m���ɴ˺����ڻ��ϼۺ�Ϊ0�ã�3+x-n-��6-n��=0��x=3������PAFC����Ԫ�صĻ��ϼ�Ϊ+3�� (2)���Ϻ��н��������������������ϡ�����Ϻ����˶����ѧ��Ӧ���ڷ�������Щ��Ӧ�У������������ᷴӦ����������ԭ��Ӧ��Ϊ�û���Ӧ���������η�Ӧ����������ԭ��Ӧ���������Ĵ������Ӧ���ͣ�����Ϸ�Ӧ�����ӷ���ʽΪAl+3Fe3+=Al3++3Fe2+��(3)�����������Լ������������ʵ�����ϵ��ȷ��������ȷ����Һ����Ԫ�صĴ�����ʽ�Ƿ���Fe3+������������Һ�У�����ȷ���Ƿ�һ������������ΪFe3+����ȷ�ϸ������Ƿ������õ��Լ�����Ϊ���軯����Һ��(4)�Լ�X��������������֤�������ӱ�����Ϊ�����ӣ��Ҳ��������µ����ʣ�A��FeΪ��ԭ���������ϣ� B��HNO3 Ϊ����������Ӧ�������������������ӣ������ϣ�C����ˮΪ�������ҷ�Ӧ�����������ʣ����ϣ�D�����������ҺΪ����������Ӧ����������ʣ������ϡ���ѡC��(5)ˮ���γɵľۺ����ɢ��ˮ�е�����ֱ����1nm��100nm֮�䣬�ü�ʵ�������֤�÷�ɢϵΪ����һ����ͨ���������Կ���һ�������ġ�ͨ·�����������������(6)PAFC�м����������������Һ��Ӧ��������������������ƫ�����ƺ��Ȼ��ƣ��ʲ���I������Ϊ���ˣ�(7)ͨ�������A���弴������̼���壬ƫ�����Ʒ�Ӧ��������������̼�����ƣ���Ӧ�����ӷ���ʽΪAlO2+CO2+2H2O=Al(OH)3��+HCO3��


 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�������֪����ĵ��볣��Ka=1.6��10-5�����������ܶȻ�Ksp(CH3COOAg)=3.7��10-3�������й�˵����ȷ����
A. ������Һ�У�c(CH3COO-)>c(H+)>c(OH-)
B. ����ͬŨ�ȵ�CH3COOH��Һ��CH3COO Na��Һ�������ϣ�������Һ�ʼ���
C. ���¶��£�1mol/L�Ĵ�����Һ�У�����ĵ����Ϊ0.4%
D. ���¶�����Ũ�Ⱦ�Ϊ0.02mol/L��CH3COONa��Һ��AgNO3��Һ��������(���Ի�Ϻ���Һ����ı仯)����CH3COOAg��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����10mL.0.1mol/LCaCl2��Һ�еμ�0.1mol/L��Na2CO3��Һ���μӹ�������Һ��-1gc(Ca2+)��Na2CO3��Һ���(V)�Ĺ�ϵ��ͼ��ʾ�������й�˵����ȷ���ǣ� ��
(��֪1g5=0.7)
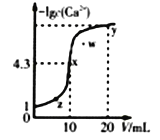
A. x��y����c(Ca2+)֮��Ϊ2000:3 B. Ksp(CaCO3)=5��10-9
C. w���Ӧ�ķ�ɢϵ���ȶ� D. x��y��z�����У�ˮ�ĵ���̶�����Ϊx��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ÿɱ��Ϊ����ij��ҵ�����������ΪAl2O3��FeO��Fe2O3�ȡ���ͼ���Ըù������Ϊԭ����ȡ������������Fe3O4�������ӵ�һ�ֹ�������:
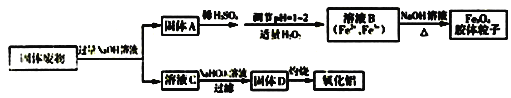
(1)�����Ʊ�Fe3O4�������ӳɹ���ʵ�����������____________________________��
(2)д������ҺB�Ʊ�����Fe3O4�������ӵ����ӷ���ʽ__________________________________��
(3)����ҺB�Ƶ�Fe3O4�������ӵĹ����У������ͨ��N2����ԭ����____________________________��
(4)����ҺC�м���NaHCO3��Һ����Һ��pH_________(����������䡱��С��)��
(5)����D��Al(OH)3������ʱAl(OH)3����NaOH��Һ��Ӧ��ƽ�ⳣ������20�����ʱAl(OH)3![]() A1O2-+H++H2O�ĵ��볣��K=_______________��
A1O2-+H++H2O�ĵ��볣��K=_______________��
(6)����·���(K2Cr2O7)�ɲⶨ�������Fe3O4������������Ԫ�صĺ�������������ͼ����֪����Ӧ��K2Cr2O7����ԭΪCr3+��

��д���ס��ҵĻ�ѧ����ʽ___________________________________��
��д���ҡ��������ӷ���ʽ_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������AlN���㷺Ӧ���ڵ��ӡ��մɵȹ�ҵ������һ�������£�AlN�ĺϳɷ�ӦΪ��Al2O3+N2+3C=2AlN+3CO���÷�Ӧ�з���������Ӧ��������
A.Al2O3B.N2C.CD.Al2O3 ��C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦmA��s��+nB��g��pC��g����H��0����һ���¶��£�ƽ��ʱB�����������B%����ѹǿ�仯�Ĺ�ϵ��ͼ��ʾ������������һ����ȷ���ǣ�������
��m+n��p ��y���ʾ������Ӧ����С���淴Ӧ����
��n��p ��x���y��ʱ�ķ�Ӧ������
���������¶ȣ��÷�Ӧ��ƽ�ⳣ������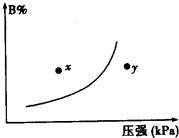
A.�٢ڢ�
B.�ڢܢ�
C.ֻ�Т٢�
D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ұ���������Һʱ��ʹ����ɫ����ƿ���ǣ� ��
A.��������Һ
B.���Ը��������Һ
C.��ˮ
D.ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⼰�仯�����ںϳ�ɱ������ҩ��ȷ�����й㷺��;���ش��������⣺
��1�������ĵ⸻���ں����У���ˮ��ȡ��Ũ��������Ũ��Һ�м�MnO2��H2SO4 �� ���ɵõ�I2 �� д���÷�Ӧ�����ӷ���ʽ ��
��2��һ�ֵ�����Ļ����I4O9�������Գ�Ϊ����⣬��I4O9�е�Ԫ�صĻ��ϼ��� ��
A.��1
B.+1
C.+3
D.+5
��3����IOH�����Ի����д��IOH����ʽ����ĵ��뷽��ʽ ��
��4����֪��Ӧ2HI��g���TH2��g��+I2��g����H=+11kJmol��1 �� 1mol H2��g����1mol I2��g�������л�ѧ������ʱ�ֱ���Ҫ����436kJ��151kJ����������1mol HI��g�������л�ѧ������ʱ�����յ�����ΪkJ��
��5��Bodensteins�о������з�Ӧ��2HI��g��H2��g��+I2��g������716Kʱ�����������е⻯������ʵ�������x��HI���뷴Ӧʱ��t�Ĺ�ϵ�����
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x��HI�� | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x��HI�� | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
�ٸ�������ʵ�������÷�Ӧ��ƽ�ⳣ��K�ļ���ʽΪ�� ��
��������Ӧ�У�����Ӧ����Ϊ����=k��x2��HI�����淴Ӧ����Ϊ����=k��x��H2��x��I2��������k����k��Ϊ���ʳ�������k��Ϊ����K��k����ʾ����
��������ʵ�����ݼ���õ�������x��HI���ͦ�����x��H2���Ĺ�ϵ������ͼ��ʾ�������ߵ�ijһ�¶�ʱ����Ӧ���´ﵽƽ�⣬��Ӧ�ĵ�ֱ�Ϊ������ĸ����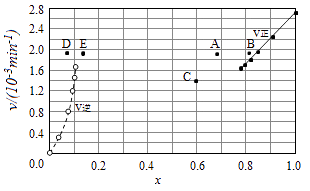
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ���������Ԫ��W��X��Y��Z��ԭ��������������W��X�ļ����Ӿ�����ͬ���Ӳ�ṹ��X��ԭ�Ӱ뾶�Ƕ���������Ԫ��ԭ�������ģ�W��Yͬ�壬Z��X�γɵ����ӻ������ˮ��Һ�����ԣ�����˵����ȷ���ǣ�������
A.�����Ӱ뾶��W��X��Z
B.W��X�γɵĻ���������ˮ����Һ�ʼ���
C.��̬�⻯������ȶ��ԣ�W��Y
D.����������ˮ��������ԣ�Y��Z
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com