
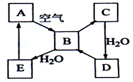
 如图表示某固态单质A(淡黄色)及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A(淡黄色)及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.分析 固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2,C为SO3,它们的相对分子质量为64:80=4:5,恰好与题意相符(同时也证明A不是C),则D为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明A为S,E为H2SO3,结合物质的性质以及题目要求可解答该题.
解答 解:固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2,C为SO3,它们的相对分子质量为64:80=4:5,恰好与题意相符(同时也证明A不是C),则D为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明A为S,E为H2SO3,
(1)A为S,可与氢气反应生成硫化氢,反应的化学方程式为:H2+S $\frac{\underline{\;\;△\;\;}}{\;}$H2S,该反应中S元素化合价降低被还原,在反应中做氧化剂,
故答案为:H2+S $\frac{\underline{\;\;△\;\;}}{\;}$H2S;S;
(2)H2SO3与H2S反应生成S,反应的化学方程式为:H2SO3+2H2S═3S↓+3H2O,硫化氢中S元素的化合价升高被氧化,则还原剂是H2S,
故答案为:H2SO3+2H2S═3S↓+3H2O;
(3)浓硫酸可与C、Cu等还原性物质在加热的条件下反应生成SO2,反应的方程式可为:C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等,两个反应中氧化剂都是浓硫酸,
故答案为:C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O(或Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O);浓硫酸;
(4)①将5mL 0.10mol•L-1的H2SO3溶液与10mL 0.10mol•L-1的NaOH溶液混合,二者恰好反应,反应的离子方程式为H2SO3+2OH-═SO32-+2H2O,
故答案为:H2SO3+2OH-═SO32-+2H2O.
点评 本题考查无机物的推断,注意能与氧气反应生成气体的固体单质有C、S等元素,可以此作为该题的突破口进行推断,注意把握物质的化学性质,能熟练书写反应的化学方程式.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时OH-向负极移动 | |
| B. | Ag2O2在反应中既是氧化剂又是还原剂 | |
| C. | 每生成1mol Ag外电路转移2 mol电子 | |
| D. | 负极反应为:Zn+4OH--2e-═Zn(OH)42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4ac/bNA | B. | 22.4ab/cNA | C. | 22.4bc/aNA | D. | 22.4b/acNA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ④⑤⑥ | C. | ①②⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com