
(10分) )氮元素有着多变价态和种类繁多的化合物,因在生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)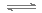 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
T | 298 K | 398 K | 498 K | … |
K | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”)。
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
A.2v(H2)正=3v(NH3)逆 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡常数_____。(填“增大”、“减小”或“不变”)
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)____ Ksp(AgBr) (填“>”、“=”或“<”)。
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4。
①298 K时,1.00 g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15 kJ的热量。写该反应的热化学方程式_____________________________________。
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式____________________。
(1) ①> (1分) ②A、C、D(2分); ③减小 (1分); 不变(1分; ④ > (1分);
(2) ① 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l) ΔH=-1225.6 kJ/mol (2分)
② N2H4-4e-=N2+4H+ (2分)
【解析】
试题分析:(1) ①由于该反应的正反应是放热反应,所以升高温度,根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,及该反应向逆反应方向移动,所以K1>K2;②A.2v(H2)正=3v(NH3)逆,则物质的浓度不变,反应达到平衡,正确;B.3v(N2)正=v(H2)逆则物质的浓度不变,反应达到平衡,而本题中v(N2)正=3v(H2)逆,物质的浓度发生改变,反应未达到平衡,错误;C.由于该反应是反应前后气体体积不等的反应,所以若容器内压强保持不变,则反应达到平衡,正确;D.因为反应前后气体的物质的量不等,而参加反应的物质都是气体,质量不变,所以若混合气体的平均摩尔质量保持不变,则气体的物质的量不变,反应达到平衡,正确。③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,则容器的容积扩大,物质的浓度减小,所以此时逆反应速率减小;由于温度不变,所以平衡常数不变;④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,说明在前者的溶液中Ag+的浓度大,则Ksp(AgCl) > Ksp(AgBr);( 2 )①根据题意可得该反应的热化学方程式是2N2H4(l)+N2O4(l) =3N2(g)+ 4H2O(l) ΔH=-1225.6 kJ/mol;②由于该反应是氧化还原反应,所以可以设计成原电池。燃料N2H4作原电池的负极,N2O4是原电池的正极材料;负极反应式是N2H4-4e-=N2+4H+ 。
考点:考查化学平衡常数的比较、平衡状态的判断、物质溶解度大小的比较、热化学方程式的书写、原电池反应原理的应用的知识。


 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关热化学方程式的表示及说法正确的是( )
A.已知C(石墨,s)= C(金刚石,s) △H>0,则金刚石比石墨稳定
B.已知I2(g)+H2(g)=2HI(g) △H1;I2(s)+H2(g)=2HI(g) △H2;
则△H1<△H2
C.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol
D.已知H2(g)+F2(g)=2HF(g) △H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高一下学期期末考试化学试卷(解析版) 题型:选择题
已知在一定条件下, 2SO2+O2 2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
A. 大于45.3% B. 小于45.3% C. 等于45.3% D. 无法确定
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是
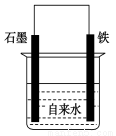 A.正极的电极方程式为:O2+2H2O+4e-===4OH-
A.正极的电极方程式为:O2+2H2O+4e-===4OH-
B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
常温下,下列离子能使纯水中的H+离子数目增加的是( )
A.S2-B.CO32-C.NH4+D.Br-
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学试卷(A卷)(解析版) 题型:选择题
在溶液中,CaCl2+CO2+H2O=CaCO3↓+2HCl在任何条件下都不能发生,原因是该反应的( )
A. △H >0 ΔS>0 B.△H<0 ΔS<0 C.△H<0 ΔS>0 D.△H >0 ΔS<0
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学试卷(A卷)(解析版) 题型:选择题
如图,将纯Fe棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是( )
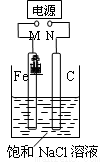
A.M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况)时,生成1 mol NaOH
B.M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红
C.M接负极,N接正极,若把烧杯中溶液换成1 L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀
D.M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(B卷)试卷(解析版) 题型:实验题
(12分)第29届奥运会祥云火炬的外壳材料是高强度的铝镁合金。某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数,他们利用盐酸、氢氧化钠溶液设计了三种不同的实验方案:
方案一:铝镁合金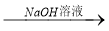 测定生成气体的体积
测定生成气体的体积
方案三:铝镁合金 溶液
溶液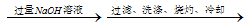 称量灼烧产物的质量。
称量灼烧产物的质量。
(1)写出方案一中发生反应的离子方程式 。
(2)实验小组根据方案二设计了两个实验装置,如下圈(图中的铁架台已省略)。
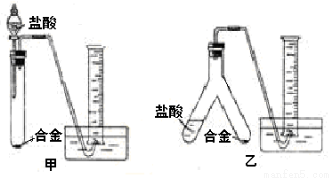
你认为选择 (选填甲或乙)装置进行实验更合理,误差更小。
(3)用方案三进行实验时,除了称量灼烧产物质量外,还需称量的是 。
(4)拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示:
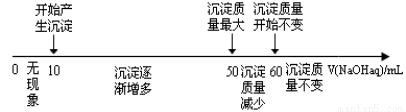
请你判断,根据上图数轴申的数据能否求出合金中镁的质量分数? (选填“能”或“不能”)
下列①②两题选一题作答。
①若不能求出合金中镁的质量分数,请说明理由 。
②若能求出合金中镁的质量分数,则镁的质量分数为 (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:选择题
以下物质间的每步转化都可以通过一步反应能实现的是( )
A.Al-Al2O3-Al(OH)3-NaAlO2 B.Fe-FeO-Fe(OH)2-Fe(OH)3
C.Si-SiO2-H2SiO3-Na2SiO3 D.Na-Na2O2-Na2CO3-NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com