
| A.金刚石和石墨 | B.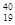 X和 X和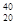 X X |
| C.D2O和H2O | D.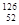 Y和 Y和 Y Y |
科目:高中化学 来源:不详 题型:单选题
| A.原子序数:X>Y | B.a -n =b+m |
| C.离子半径:Xn-> Ym+ | D.原子半径:X>Y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
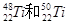
| A.在周期表中位置相同,都在第4纵行 |
B.CO2的分子模型: |
| C.在CS2、PCl3中各原子最外层均能达到8电子的稳定结构 |
| D.HF、HCl、HBr、HI的稳定性依次增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 b
b  c
c 
 点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。
点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.各原子轨道的伸展方向按p、d、f的顺序分别为3、5、7 |
| B.核外电子云表示电子在核外单位体积的空间出现的机会多少 |
| C.原子轨道伸展方向与能量大小是无关的 |
| D.原子核外可能有两个电子的运动状态是完全相同的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| Q | 只有一种能级,其电子总数等于能层序数 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.在250 mL的容量瓶中定容配成250 mL烧碱溶液 |
| B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂 |
| C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解 |
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读 数为V1 数为V1 |
 ______________________________________。
______________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 题:
题: 。
。
 在加热的条件下B、D形成的化合物的电子式为 ,其中的化学键的类型为 。
在加热的条件下B、D形成的化合物的电子式为 ,其中的化学键的类型为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ________HClO4
________HClO4查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com