
���� �������������ӡ�ͭ���ӡ����������ӵ�������ǿ���жϷ�Ӧ�Ⱥ�˳��
����Ӧ����ͭ���ɣ�������ʣ�࣬��һ�������������Ӵ��ڣ�һ�������������ӣ����ܺ���ͭ���ӣ�
����ַ�Ӧ��������ʣ�࣬�����������ӡ�ͭ����һ����ȫ��Ӧ���ݴ˽�Ϸ�Ӧ����ʽ������
��� �⣺Fe3+��Cu2+��Fe2+�����������μ������������ۣ�����Fe3+��Ӧ������Cu 2+��Ӧ��
��1������ͭ���ɣ�������ʣ�࣬��Һ��һ��û��Fe3+��Cu2+ǡ��ȫ���μӷ�Ӧ�ַ�Ӧ����Fe2+��Cu��������Һ��һ��û��Fe3+�����ܺ���Cu2+��һ������Fe2+��
���ֻ��Fe2+���������ʵ���Ϊ��0.35mol���������Cu2+�������Ϊ0.1molʱ��ֻ����2FeCl3+Fe=3FeCl2����Fe2+���ʵ���Ϊ0.25mol������������Ӧ������������Cu2+С��0.1mol�����Fe2+���ʵ�������0.25mol����Fe2+���ʵ���Ϊ��0.25mol��n��Fe2+����0.35mol��
�ʴ�Ϊ��Fe2+��0.25mol��n��Fe2+����0.35mol��
��2���ٵ�������ʣ��ʱ����Һ�е�Fe3+��Cu2+ȫ���μӷ�Ӧ����Fe2+��Cu����Ӧ�ķ�Ӧ����ʽΪ��2FeCl3+Fe�T3FeCl2��CuCl2+Fe�TCu+FeCl2����Һ��һ��û��Fe3+��Cu2+��һ������Fe2+����Ӧ����Һ�е�����Ϊ�Ȼ������������������غ㣺n��Cl-��=��1mol/L��3+1mol/L��2+1mol/L��2����0.1L=0.7mol������n��Fe2+��=$\frac{1}{2}$n��Cl-��=0.35mol��
�ʴ�Ϊ��Fe2+��0.35��Fe3+��Cu2+��
�ڵ�������ʣ��ʱ����Һ�е�Fe3+��Cu2+ȫ���μӷ�Ӧ����Fe2+��Cu�����Թ����к���Fe��Cu��
���ݷ���ʽ��2FeCl3+Fe�T3FeCl2��CuCl2+Fe�TCu+FeCl2����Ӧ����������Ϊn��Fe��=$\frac{1}{2}$n��FeCl3��+n��Cu��=$\frac{1}{2}$��2mol/L��0.1L+2mol/L��0.1L=0.3mol������Ϊ��0.3mol��56g/mol=16.8g����Ӧ���ɵ�ͭΪn��Cu��=2mol/L��0.1L=0.2mol������Ϊ��0.2mol��64g/mol=12.8g��������������16.8g-12.8g=4g��
�ʴ�Ϊ��Fe��Cu���٣�4��
���� ���⿼��Fe��Fe3+��Cu2+�ķ�Ӧ���Ѷ��еȣ�Ҫע����ݹ���ijɷ��˽ⷴӦ���Ⱥ�˳�Ӷ�ȷ����Һ�ijɷ֣������ڿ���ѧ���ķ��������ͼ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
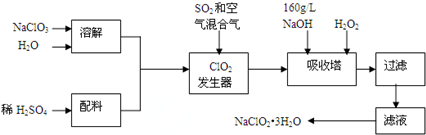
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪2C��s��+O2��g��=2CO��g����H=-221 kJ•mol-1�����֪C�ı�ȼ����Ϊ110.5 kJ•mol-1 | |
| B�� | ��101KPa�������ı�ȼ���ȡ�H=-285.5 kJ•mol-1����ˮ�ֽ���Ȼ�ѧ����ʽ��2H2O��l��=2H2��g��+O2��g����H=+285.5 kJ•mol-1 | |
| C�� | ϡ������0.1 mol/LNaOH��Һ��Ӧ��H+��aq��+OH-��aq��=H2O��l����H=-57.3 kJ•mol-1 | |
| D�� | �ܱ������У�9.6 g�����11.2 g���ۻ�ϼ�������������17.6 gʱ���ų�19.12 kJ��������Fe��s��+S��g��=FeS��s����H=-95.6 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ü���ʼ��鶹���Ķ�������� | |
| B�� | ����ķ�ɢ������ֱ��С��l00nm������1nm����ͨ����ֽ����������Ĥ | |
| C�� | ���������ƶ��������ǵ������Һ�����ԭ�� | |
| D�� | ����ȡ�ķ����������ͺ�ú�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ۢ� | C�� | �ڢۢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
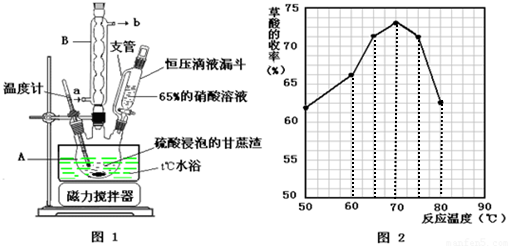
| ��һ�� | �ڶ��� | ������ | |
| �����mL�� | 16.10mL | 16.60mL | 15.90mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȡ100mL5mol/LH2SO4������400mLˮ | |
| B�� | ȡ200mL5mol/LHCl����ˮϡ����500mL | |
| C�� | ȡ200 mL5mol/LH2SO4����ˮϡ����500mL | |
| D�� | ȡ100 mL5mol/LHNO3����ˮϡ����500mL |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com