
 以下元素均为短周期元素:
以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第三周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.分析 短周期元素中,非金属元素M的气态氢化物的水溶液呈碱性,则M为N元素;A的单质与冷水剧烈反应,得到强碱性溶液,则A为Na;B的原子最外层电子数是 内层电子数的三倍,原子只能有2个电子层,最外层电子数为6,则B为O元素;在第三周期中,C的简单离子半径最小,则C为Al;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl;所有有机物中都含有E元素,则E为碳元素.
解答 解:短周期元素中,非金属元素M的气态氢化物的水溶液呈碱性,则M为N元素;A的单质与冷水剧烈反应,得到强碱性溶液,则A为Na;B的原子最外层电子数是 内层电子数的三倍,原子只能有2个电子层,最外层电子数为6,则B为O元素;在第三周期中,C的简单离子半径最小,则C为Al;A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,X为NaClO,D为Cl;所有有机物中都含有E元素,则E为碳元素.
(1)D的最低价含氧酸为HClO,电子式 为: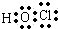 ,
,
故答案为: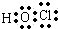 ;
;
(2)M的简单气态氢化物为NH3,与氧气形成燃料电池(KOH为电解液),负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水,负极反应方程式为:2NH3-6e-+6OH-═N2+6H2O,
故答案为:2NH3-6e-+6OH-═N2+6H2O;
(3)仅由Na、O、C组成的一种生活中的常用盐,其中A(Na)的质量分数为43%,则A为Na2CO3,其水溶液与氯气物质的量比为1:1反应的离子方程式为:CO32-+Cl2+H2O=ClO-+Cl-+HCO-3,
故答案为:CO32-+Cl2+H2O=ClO-+Cl-+HCO-3;
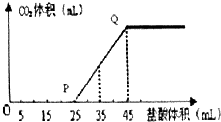
(4)①OP段一定发生反应:Na2CO3+HCl=NaHCO3+NaCl,PQ段发生:NaHCO3+HCl═NaCl+H2O+CO2↑,而OP段消耗的盐酸大于PQ段消耗的盐酸,故X为NaOH和Na2CO3的混合物,
故答案为:NaOH和Na2CO3;
OA段所发生反应:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl;
②当加入35mL盐酸时,有10mL盐酸反应生成二氧化碳,其物质的量为1mol/L×0.01L=0.01mol,由NaHCO3+HCl═NaCl+H2O+CO2↑,可知生成二氧化碳为0.01mol,产生CO2的体积为0.01mol×22.4L/mol=0.224L,即为22.4mL,
故答案为:224.
点评 本题考查结构性质位置关系应用,涉及电子式、原电池、混合物的计算等,题目难度中等,(4)中关键是根据图象判断溶液溶质的成分.


科目:高中化学 来源: 题型:解答题
 ,名称是3,4-二甲基辛烷.
,名称是3,4-二甲基辛烷. 名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol.
名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol. 名称是3-甲基-4-乙基-3-己烯
名称是3-甲基-4-乙基-3-己烯 名称是2,2,3-三甲基戊烷
名称是2,2,3-三甲基戊烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热蒸发K2CO3溶液的方法获得K2CO3晶体 | |
| B. | 用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 | |
| C. | 用Na2S溶液和CuSO4溶液反应无法制取CuS固体 | |
| D. | 加热MgCl2溶液制取MgCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 氢氟酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeC13溶液 | Cu | 浓硝酸 |
| A. | ①③④ | B. | ①②④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液中:Mg2+、Fe3+、SO42-、Cl- | |
| B. | 酸性溶液中:NH4+、Na+、ClO-、SO42- | |
| C. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| D. | 滴入KSCN溶液显红色的溶液中:Na+、K+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
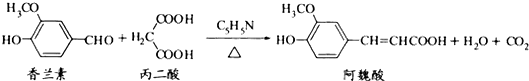
| A. | 与香兰素互为同分异构体,分子中有5种不同化学环境的氢,且能发生银镜反应的酚类化合物有2种 | |
| B. | 香兰素、阿魏酸均可与NaHCO3、NaOH溶液反应 | |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 | |
| D. | 香兰素、阿魏酸均可与溴水反应,且反应类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ○ |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
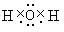 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com