
【题目】1 mol/L H2SO4的含义是
A.1L 水中含有1mol H2SO4 B.1L 溶液中含有1mol H+
C.1L H2SO4溶液中含98g H2SO4 D.将98g H2SO4溶于1L水配成溶液
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】电池中负极与电解质溶液接触直接反应会降低电池的能量转化效率,称为自放电现象。如图所示,下列关于干电池和铅蓄电池的说法错误的是

A. 干电池为一次性电源,铅蓄电池为二次电源
B. 干电池中MnO2的放电产物可能是KMnO4
C. 铅蓄电池存在自放电现象
D. 铅蓄电池中负极反应式为:Pb-2e-+SO42-=PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓地通入到含KOH、Ba(OH)2和K[Al(OH)4]的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是

A. o—a段反应的化学方程式是:Ba(OH)2 + CO2 = BaCO3↓+ H2O
B. b—c段反应的离子方程式是:2[Al(OH)4]-+ CO2 = 2Al(OH)3↓ +CO32-+ H2O
C. a—b段与c—d段所发生的反应相同
D. d—e段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以用废铁屑制备活性Fe3O4,流程如下图:

(1)在制备过程中,要将块状固体原料粉碎、磨成粉末,作用是________________________
(2)在合成池里生成Fe3O4的离子方程式为__________________________
(3)根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近________
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如图(夹持装置略,气密性已检验):
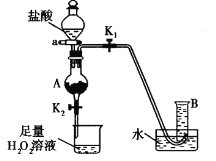
操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
① 操作Ⅱ中“……”的内容是______________,烧杯中的现象是_________________,并有气泡产生。相应的方程式是________________、________________。(是离子反应的写离子方程式)
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是![]() ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是 ( )
A. CuO+2H+==Cu2++H2O B. CaCO3+2H+==Ca2++CO2↑+H2O
C. 2Fe+6H+==2Fe3++3H2↑ D. Cu(OH)2+2H+==Cu2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某工业生产过程。

溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________

A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示(部分产物略去)。

I.若A是能使湿润红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种常见无色无味的有毒气体,B、E均为汽车尾气成分。
(1)写出反应①的化学方程式____________。
(2)写出B和E在催化剂条件下生成C的化学方程式______________。
II.若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子粒子;E为澄清石灰水。
(1)写出反应②的化学方程式_____________。
(2)将一定量的气体D通入2L C的溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。

①O点溶液中所含溶质的化学式为_______,横坐标3-5段发生的离子方程式为_____。
②标况下,通入气体D的体积为______L,C溶液的物质的量浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)观察实验装置,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是_________________________。
(3)大烧杯上口不盖硬纸板,测得的中和热数值 __________(填“偏大、偏小、无影响”)。
(4)实验中改用55mL 0.50 mol/L盐酸与55mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________ (填“相等、不相等”)。
(5)在中和热测定实验中,若用相同浓度和体积的氨水代替NaOH溶液进行实验,测得的中和热的数值会____(填“偏大”、“偏小”“不变”)原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A. υ(C)=4 mol·(L·s)-1B. υ(B)=6 mol·(L·s)-1
C. υ(A)=3 mol·(L·s)-1D. υ(D)=2mol·(L·s)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com