
 某实验小组对一含有Al3+的未知溶液进行了如下分析:
某实验小组对一含有Al3+的未知溶液进行了如下分析:| A. | 该未知溶液中一定含有Al3+ Mg2+ H+三种阳离子 | |
| B. | 滴加的NaOH溶液的物质的量浓度为5 mol•L-1 | |
| C. | 若将最终沉淀过滤、洗涤、灼烧,其质量可能为6 g | |
| D. | 若另一种离子为二价阳离子,则a=10 |
分析 A、依据实验过程分析滴入氢氧化钠无沉淀,说明含有H+,继续滴入氢氧化钠溶液生成白色沉淀说明一定生成氢氧化铝沉淀,说明溶液中含有Al3+,加入过量的氢氧化钠溶液沉淀减少,图象分析说明溶液中除了铝离子,应还有另一种金属阳离子;
B、依据图象分析溶解的氢氧化铝物质的量为0.20mol-0.15mol=0.05mol,消耗氢氧化钠溶液体积=110ml-100ml=10ml,氢氧化钠的浓度=$\frac{0.05mol}{0.01L}$=5mol/L;
C、最后得到的沉淀不能确定其成分,所以不能计算灼烧后得到的氧化物的质量,若果为氧化镁,按照方程式计算;
D、若另一种阳离子为二价金属阳离子,依据离子反应过程金属分析判断,氢氧化铝形成最大沉淀量0.05mol,二价金属物质的量为0.15mol,消耗氢氧化钠物质的量为0.05mol×3+0.15mol×2+a×10-3L×5mol/L=0.1L×5mol/L,a=10ml.
解答 解:A、实验过程分析滴入氢氧化钠无沉淀,说明含有H+,继续滴入氢氧化钠溶液生成白色沉淀说明一定生成氢氧化铝沉淀,说明溶液中含有Al3+,加入过量的氢氧化钠溶液沉淀减少,图象分析说明溶液中除了铝离子,应还有另一种金属阳离子,该未知溶液中至少含有3种阳离子,但不一定是镁离子,故A产错误;
B、依据图象分析溶解的氢氧化铝物质的量为0.20mol-0.15mol=0.05mol,消耗氢氧化钠溶液体积=110ml-100ml=10ml,氢氧化钠的浓度=$\frac{0.05mol}{0.01L}$=5mol/L,故B正确;
C、最后得到的沉淀不能确定其成分,若沉淀为氢氧化铝和氢氧化镁,根据原子守恒,则氧化铝为0.025mol,氧化镁为0.15mol,固体质量为0.025×102+0.15×40=6g,故C正确;
D、若另一种阳离子为二价金属阳离子,生成氢氧化铝最大沉淀量0.05mol,二价金属物质的量为0.15mol,开始消耗氢氧化钠体积为aml,消耗氢氧化钠物质的量为0.05mol×3+0.15mol×2+a×10-3L×5mol/L=0.1L×5mol/L,a=10,故D正确;
故选A.
点评 本题考查了图象分析的方法掌握,物质性质的分析应用,定量计算和图象中的定量分析是解题关键,题目难度较大.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 已知NH4F水溶液中含有HF分子,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应是吸热反应 | |
| B. | 需要加热的反应都是吸热反应 | |
| C. | 断裂化学键要吸收能量 | |
| D. | 反应物总能量一定等于生成物总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
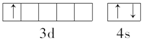 ,该元素基态原子结构示意图
,该元素基态原子结构示意图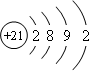 .该元素的名称为钪,形成的单质为金属晶体.
.该元素的名称为钪,形成的单质为金属晶体. 中心原子的杂化方式为
中心原子的杂化方式为查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 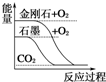 石墨转变成金刚石是吸热反应 | |
| B. | 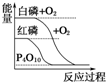 白磷比红磷稳定 | |
| C. | 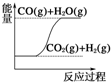 CO(g)+H2O(g)═CO2(g)+H2(g)△H>0 | |
| D. | 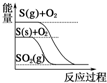 S(g)+O2(g)═SO 2(g)△H1 S(g)+O2((g)═SO2((g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
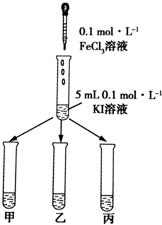 某学习小组通过下面的实验一和实验二,探究某些化学理论.
某学习小组通过下面的实验一和实验二,探究某些化学理论.| 序号 | 反应温度/℃ | C(HCl)/mol•L-1 | V(HCl)/ml | 10g碳酸钙的形状 | t/min |
| ① | 20 | 2 | 10 | 块状 | t 1 |
| ② | 20 | 4 | 10 | 块状 | t 2 |
| ③ | 20 | 2 | 10 | 粉末 | t 3 |
| ④ | 40 | 2 | 10 | 粉末 | t 4 |
| ⑤ | 40 | 4 | 10 | 粉末 | t5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 (g)+2O2(g)═CO2 (g)+2H2O(l)△H=a kJ•mol-1 CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=b kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=a kJ•mol-1 H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=b kJ•mol-1 | |
| C. | C(s)+$\frac{1}{2}$O2 (g)═CO(g)△H=a kJ•mol-1 C(s)+O2(g)═CO2(g)△H=b kJ•mol-1 | |
| D. | S(g)+O2(g)═SO2 (g)△H=a kJ•mol-1 S(s)+O2(g)═SO2(g)△H=b kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com