
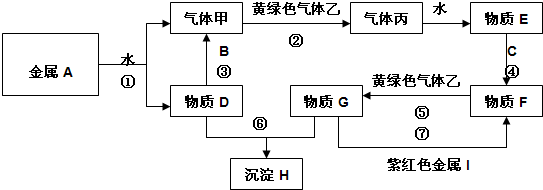


科目:高中化学 来源: 题型:
| A、①②③ | B、①②④ |
| C、①②③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、常温常压下,22.4LCO2中含有的CO2分子数小于NA个 |
| C、等物质的量的N2和CO的质量均为28g |
| D、常温下,1L 0.1mol/LNa2CO3溶液中,含有阴离子的总数小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
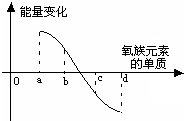 元素周期律是指导我们学习元素及其化合物知识的重要工具.已知氧族元素(不含Po)的部分知识如下表所示,
元素周期律是指导我们学习元素及其化合物知识的重要工具.已知氧族元素(不含Po)的部分知识如下表所示,| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 450 | |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 元素主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
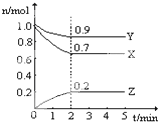 Ⅰ、A和B反应生成C,假定反应刚开始只有A、B,它们的起始浓度均为1mol/L.反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L.则在这2min内反应的平均速率VA=
Ⅰ、A和B反应生成C,假定反应刚开始只有A、B,它们的起始浓度均为1mol/L.反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L.则在这2min内反应的平均速率VA=查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性Cr2O72->Fe3+>SO2 |
| B、能将Na2SO3氧化成Na2SO4 |
| C、每有1 mol K2Cr2O7参加反应,转移电子的数目为3NA |
| D、若6.72 L SO2(标准状况)参加反应,则最终消耗0.1 mol K2Cr2O7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com