
| A. | pH只适用于稀溶液,对于c(H+)>1 mol/L时,一般不用pH而直接用H+的浓度表示 | |
| B. | 水的电离、弱酸、弱碱的电离及盐类水解都是吸热的 | |
| C. | pH每增加一个单位,c(H+) 则减少10倍 | |
| D. | 25℃纯水中加入盐酸后,pH<7,此时水的离子积常数KW≠1×10-14 |
分析 在一定温度时,c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积.
Kw=c(H+)•c(OH-),25℃时,Kw=1×10-14,Kw只受温度影响,水的电离吸热过程,温度升高,水的电离程度增大,Kw增大.
解答 解:A.pH为氢离子浓度的负对数,适合氢离子浓度小于或等于0.1mol/L的溶液,范围为1-14,即氢离子浓度为1,pH=0,一般直接利用氢离子浓度表示,故A正确;
B.电离与水解均是吸热过程,故B正确;
C.pH为氢离子浓度的负对数,pH每增加一个单位,c(H+) 则减少10倍,故C正确;
D.25℃时,Kw=1×10-14,Kw只受温度影响,故D错误,
故选D.
点评 本题主要考查的是水的电离以及水电离的影响因素以及水的离子积常数,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
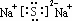 ;其水溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
;其水溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
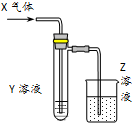 用以如图示装置研究物质的性质,能够获得可靠结论的是( )
用以如图示装置研究物质的性质,能够获得可靠结论的是( )| X | Y | Z | 结论 | |
| A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
| B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
| C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
| D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和NaHCO3溶液中通入过量CO2:CO32-+CO2+H2O═HCO3- | |
| B. | 金属铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | Ca(OH)2溶液与Na2CO3溶液反应:Ca2++CO32-═CaCO3↓ | |
| D. | 氯化铝与过量氨水反应:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA | |
| B. | 1L0.1 mol•L-1 Na2CO3溶液中含有CO32-数为0.1 NA | |
| C. | 常温常压下,18g水含有的分子数为 NA | |
| D. | 常温下,1mol Cl2与过量NaOH溶液反应,转移电子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
| 滤纸的 颜色 变化 | 玻璃片(Ⅰ) 上的滤纸 | 白色 | 白色 | 灰色 | 浅蓝色 | 蓝色 | 蓝色 | 浅蓝色 |
| 玻璃片(Ⅱ) 上的滤纸 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 浅蓝色 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com