
(14分)用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
(1) 该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是① ②(填“>”、“<”或“=”)。
(2) 若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=_______mol·L-1。(假设混合溶液体积为50 mL)
(3) 除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。
(4) 小组同学发现反应速率总是如下图,其中t1~t2时间内速率变快的主要原因可能是:
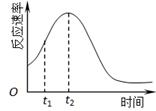
①产物Mn2+是反应的催化剂、② 。
(1)浓度(2分),<(3分)。(2)0.0052或5.2×10-3 (3分)
(3)KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间(3分)
(4)该反应放热使反应温度升高。(3分)
【解析】
试题分析:(1) 根据表格提供的数据可知:该实验探究的是浓度对化学反应速率的影响的知识;在其它条件不变时,增大反应物的浓度,化学反应速率加快,在相同的时间内反应产生的气体多,所以相同时间内针筒中所得CO2的体积大小关系是①<②;(2) 若实验①在2 min末收集了4.48 mL CO2(标准状况下),n(CO2)=4.48×10-3L÷22.4L/mol=2×10-4mol,根据反应方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 中MnO4-与CO2的物质的量的关系可知反应消耗MnO4-的物质的量是n(MnO4-)=2/10 n(CO2)= 4×10-5mol,则在2 min末,c(MnO4-)=(0.03L ×0.01 mol/L-4×10-5mol)÷0.05L=5.2×10-3mol/L;(3) 除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率。(4)根据图像可知在反应初期,随着反应的进行,化学反应速率逐渐加快,当时间达到t2时滴定最大值,后来随着反应的进行,化学反应速率逐渐减小。其中t1~t2时间内速率变快的主要原因可能是①产物Mn2+是反应的催化剂;②该反应是放热反应,反应放出的热量使反应温度升高,化学反应速率加快。
考点:考查化学反应速率的表示、比较及影响因素的知识。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:2014-2015河北保定某重点中学同步作业(必修1苏教版)1.3原子结构 题型:填空题
氢元素有1H、D、T三种原子,对于分别由它们形成的三种单质:
(1)在标准状况下,三种单质的密度之比是 。
(2)1 mol各种单质中,它们的质子数之比是 。
(3)1 g各种单质中它们的中子数之比是 。
(4)在标准状况下,1 L它们的单质中,它们的电子数之比是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高二上期开学考试化学试卷(解析版) 题型:填空题
(6分)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______________(写出其中两种物质的化学式)。
(4)ZX的电子式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高二上期开学考试化学试卷(解析版) 题型:选择题
在25℃的条件下,将体积都为10 mL,pH都等于3的醋酸和盐酸,加水稀释到a mL和b mL,测得稀释后溶液的pH均为5,则稀释时加入水的体积
A.a=b=10 mL B.a=b>10 mL
C.a<b D.a>b
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高二上期开学考试化学试卷(解析版) 题型:选择题
25 ℃时,在0.01 mol·L-1的硫酸溶液中,水电离出的H+浓度是( )
A.5×10-13 mol·L-1 B.0.02 mol·L-1
C.1×10-7 mol·L-1 D.1×10-12 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(B类)试卷(解析版) 题型:选择题
在密闭容器中发生如下反应:mA(g) + nB(g)  pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是
A.m+n>p B.平衡向逆反应方向移动
C.A的转化率降低 D.C的体积分数减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(B类)试卷(解析版) 题型:选择题
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,
C(g)+D(g)过程中的能量变化如图所示,

①正反应为放热反应,②反应物总能量低于生成物总能量,③反应物的总键能小于生成物的总键能,④1molA与1molB充分反应后,能量变化为ΔE,⑤加入催化剂后,反应加快,ΔE减小,⑥反应达到平衡时,升高温度,A的转化率增大,⑦升高温度可增大正反应速率,降低逆反应速率,⑧E2是反应C(g)+D(g)  A(g)+B(g) 的活化能,以上有关说法正确的是
A(g)+B(g) 的活化能,以上有关说法正确的是
A.⑤⑥⑦⑧ B.①②③④ C.①③⑤⑦ D.②⑥⑧
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(A类)试卷(解析版) 题型:选择题
电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是( )
A.电解时以硫酸铜溶液作电解液,精铜作阳极
B.粗铜与电源负极相连,发生氧化反应
C.阴极上发生的反应是Cu2+ + 2e-=Cu
D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且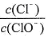 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
A.若某温度下,反应后 =11,则溶液中
=11,则溶液中 =
=
B.参加反应的氯气的物质的量等于0.5amol
C.改变温度,反应中转移电子的物质的量ne的范围: amol≤ne≤
amol≤ne≤ amol
amol
D.改变温度,产物中KC1O3的最大理论产量为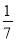 amol
amol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com