
| A. | NA个任何气体分子所占体积都约是22.4L | |
| B. | NA个H3O+含有电子数目为11NA | |
| C. | 0.5mol/L NaOH溶液中含有0.5NA个Na+ | |
| D. | NA个CO2和NO2的混合气体中氧原子数目为2NA |
科目:高中化学 来源: 题型:解答题
 有X、Z、W三种含14个电子的粒子,其结构特点如下:
有X、Z、W三种含14个电子的粒子,其结构特点如下:| 粒子代码 | X | Z | W |
| 原子核数目 | 单核 | 同种元素构成的两核 | 同种元素构成的两核 |
| 粒子的电性 | 电中性 | 两个单位负电荷 | 电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c[Fe(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
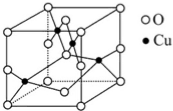 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应H2(g)+I2(g)?2HI(g)的平衡常数K=$\frac{c(HI)}{c({H}_{2})c({I}_{2})}$=49 | |
| B. | 反应2HI(g)?H2(g)+I2(g)的平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=49 | |
| C. | 反应HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)的平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=7 | |
| D. | 反应2HI(g)?H2(g)+I2(g)的平衡常数K=$\frac{c({H}_{2})c({I}_{2})}{{c}^{2}(HI)}$=$\frac{1}{49}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 选用试剂 | 操作方法 |
| A | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| B | CuSO4(H2SO4) | NaOH溶液 | 过滤 |
| C | CO2(CO) | 氧气 | 点燃 |
| D | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 减小C 或D 的浓度 | B. | 增大压强 | ||
| C. | 减小B 的浓度 | D. | 增大 A 或B的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com