
分析 2min时达到平衡,测得平衡时N2的转化率为40%,则转化的氮气为1mol×40%=0.4mol,则
N2(g)+3H2(g)?2NH3(g)
开始 1 3 0
转化 0.4 1.2 0.8
平衡 0.6 1.8 0.8
结合v=$\frac{△c}{△t}$、K为生成物浓度幂之积与反应物浓度幂之积的比、体积或压强与物质的量成正比来解答.
解答 解:2min时达到平衡,测得平衡时N2的转化率为40%,则转化的氮气为1mol×40%=0.4mol,则
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 3 0
转化l(mol):0.4 1.2 0.8
平衡l(mol):0.6 1.8 0.8
(1)平衡时v (NH3)的速率为$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/(L•min),答:平衡时v (NH3)的速率为0.2mol/(L•min);
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,该反应的平衡常数K=$\frac{(\frac{0.8mol}{2L})^{2}}{(\frac{1.8mol}{2L})^{3}×(\frac{0.6mol}{2L})}$,答:该温度下的平衡常数K=$\frac{(\frac{0.8mol}{2L})^{2}}{(\frac{1.8mol}{2L})^{3}×(\frac{0.6mol}{2L})}$;
(3)H2的体积分数为$\frac{1.8mol}{0.6mol+1.8mol+0.8mol}$×100%=56.25%,答:H2在平衡混合气体中的体积分数为56.25%;
(4)相同条件下压强之比等于物质的量之比,P后:P前=n后:n前=3.2:4=4:5,答:平衡时容器的压强与起始时压强之比为4:5.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、各物质的量的关系等为解答的关键,侧重分析与计算能力的考查,注意压强比及体积分数的计算,题目难度不大.


科目:高中化学 来源: 题型:解答题
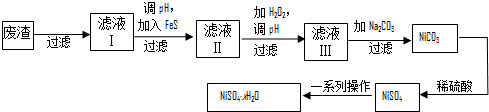
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
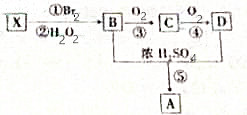 X是一种常见气态烃,它可由乙醇与浓硫酸加热到170℃制得.现以X为主要原料合成一种具有果香味的环状物质A,其合成路线如图所示.其中③、④的催化剂等条件不同;又已知RBr在碱性条件下水解生成ROH.
X是一种常见气态烃,它可由乙醇与浓硫酸加热到170℃制得.现以X为主要原料合成一种具有果香味的环状物质A,其合成路线如图所示.其中③、④的催化剂等条件不同;又已知RBr在碱性条件下水解生成ROH. +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
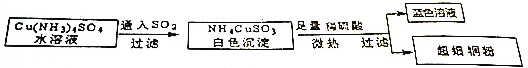
| A. | SO2在此过程中作氧化剂 | |
| B. | 超细铜粉能导电,所以超细铜粉是电解质 | |
| C. | 工业上常用电解法冶炼铜 | |
| D. | 理论上制得1mol铜粉,共转移3mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
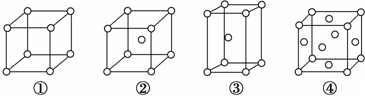
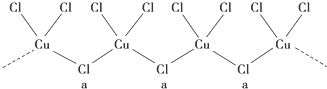
| A. | ②为六方最密堆积,③为体心立方堆积 | |
| B. | ③和④的配位数都是12 | |
| C. | 完全属于④的金属原子数为6个 | |
| D. | ③的空间利用率小于④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
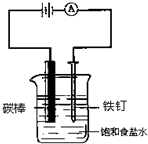
| A. | 碳酸镁 | B. | 硫酸钡 | C. | 氢氧化镁 | D. | 碳酸钡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com