
| A、该合金的熔点高于金属钠的熔点 |
| B、若将钠铝合金投入水中得到无色溶液且无固体剩余,则n(Al)>n(Na) |
| C、若将钠铝合金投入FeCl3溶液中有Fe(OH)3沉淀生成 |
| D、等质量的钠铝合金中铝的含量越大,与足量盐酸反应时放出的氢气越少 |
| 2 |
| 3 |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
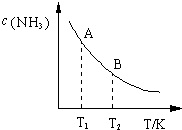 在一定条件下,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1,
在一定条件下,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1,| 时间/min 浓度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Cu2+、Cl-、SO42- |
| B、HCO3-、NO3-、SO42-、Na+ |
| C、Cl-、SO42-、K+、Na+ |
| D、Na+、SO42-、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2g | B、5.6g |
| C、2.8g | D、1.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,0.1mol?L-1HF 溶液中pH=2 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、该体系中没有沉淀产生 |
| D、该体系中HF与CaCl2反应产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com