
 铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.
铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.分析 (1)Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;
(2)根据价层电子对互斥理论确定其杂化方式;
(3)Fe原子最外层电子数为8,CO为配体,CO分子提供1对电子,进而计算x的值;
Fe(CO)x常温下呈液态,熔沸点低,易溶于非极性溶剂,可判断Fe(CO)x晶体属于分子晶体;
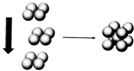
(4)Fe元素对应的单质在形成晶体时,采用如图2所示的堆积方式,则这种堆积模型为体心立方堆积,即在立方体的中心有一个铁原子,与这个铁原子距离最近的原子位于立方体的8个顶点,所以铁的配位数为8,每个晶胞中含有的铁原子数=1+8×$\frac{1}{8}$=2,如果Fe的原子半径为a cm,其体对角线为4个原子半径距离,则晶胞棱长=$\frac{4a}{\sqrt{3}}$cm,其密度=$\frac{\frac{M}{{N}_{A}}×2}{(\frac{4a}{\sqrt{3}})^{3}}$g/cm3.
解答 解:(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,则M层电子排布式为:3s23p63d5,
故答案为:3s23p63d5;
(2)尿素(H2NCONH2)分子中C原子与O原子之间形成C=O双键,与N原子之间形成C-N单键,没有孤对电子,其杂化轨道数目为3,杂化方式为sp2杂化;尿素分子中N原子的价层电子对数为$\frac{5+3}{2}$=4,所以N原子的杂化方式为sp3;
故答案为:sp2;sp3;
(3)Fe原子最外层电子数为8,CO为配体,CO分子提供1对电子,则8+2x=18,故x=5;
Fe(CO)x常温下呈液态,熔沸点低,易溶于非极性溶剂,可判断Fe(CO)x晶体属于分子晶体,
故答案为:5;分子晶体;
(4)Fe元素对应的单质在形成晶体时,采用如图2所示的堆积方式,则这种堆积模型为体心立方堆积,即在立方体的中心有一个铁原子,与这个铁原子距离最近的原子位于立方体的8个顶点,所以铁的配位数为8,每个晶胞中含有的铁原子数=1+8×$\frac{1}{8}$=2,如果Fe的原子半径为a cm,其体对角线为4个原子半径距离,则晶胞棱长=$\frac{4a}{\sqrt{3}}$cm,其密度=$\frac{\frac{M}{{N}_{A}}×2}{(\frac{4a}{\sqrt{3}})^{3}}$g/cm3=$\frac{\frac{56}{{N}_{A}}×2}{(\frac{4a}{\sqrt{3}})^{3}}$g/cm3=$\frac{112}{(\frac{4a}{\sqrt{3}})^{3}{N}_{A}}$ g/cm3,
故答案为:8;=$\frac{112}{(\frac{4a}{\sqrt{3}})^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、晶体类型判断、原子杂化方式判断、原子核外电子排布等知识点,为高频考点,难点是晶胞计算,知道价层电子对互斥理论内涵,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | SO2的摩尔质量是64g | |
| B. | SO2的摩尔质量就是相对分子质量 | |
| C. | 1mol SO2的质量是64g/mol | |
| D. | 5mol SO2中含分子数约为5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.
已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O 氧化反应 | |
| B. | 苯中加入溴水,充分振荡静置,溴水褪色 取代反应 | |
| C. | nCH2═CHCl$\stackrel{催化剂}{→}$ 加聚反应 加聚反应 | |
| D. | CH2═CH2+Br2→CH2BrCH2Br 加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com