

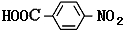
 .
.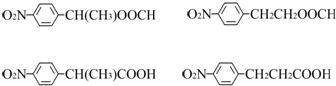 任意2种.
任意2种.
 .
. 分析 由C的还原产物结构可知,甲苯与浓硝酸在浓硫酸、加热条件下发生对位取代反应生成A,则A为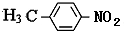 ,A中甲基被氧化为-COOH生成B,则B为
,A中甲基被氧化为-COOH生成B,则B为 ,B与乙醇发生酯化反应生成C,则C为
,B与乙醇发生酯化反应生成C,则C为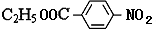 ,硝基被还原为氨基生成
,硝基被还原为氨基生成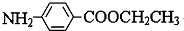 ,最后发生水解反应生成D与乙醇,则D为
,最后发生水解反应生成D与乙醇,则D为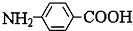 .
.
解答 解:由C的还原产物结构可知,甲苯与浓硝酸在浓硫酸、加热条件下发生对位取代反应生成A,则A为 ,A中甲基被氧化为-COOH生成B,则B为
,A中甲基被氧化为-COOH生成B,则B为 ,B与乙醇发生酯化反应生成C,则C为
,B与乙醇发生酯化反应生成C,则C为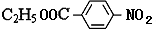 ,硝基被还原为氨基生成
,硝基被还原为氨基生成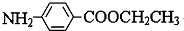 ,最后发生水解反应生成D与乙醇,则D为
,最后发生水解反应生成D与乙醇,则D为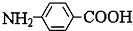 .
.
(1)由上分析可知,化合物B的结构简式为: ,
,
故答案为: ;
;
(2)由B到C是 与乙醇发生酯化反应生成
与乙醇发生酯化反应生成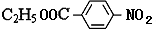 ,
,
故答案为:酯化反应;
(3)化合物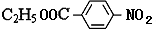 的同分异构体同时符合下列要求:①化合物是1,4-二取代苯,其中苯环上的一个取代基是硝基,②分子中含有-COO-结构的基团,符合条件的同分异构体的结构简式(E、F、G除外)有:
的同分异构体同时符合下列要求:①化合物是1,4-二取代苯,其中苯环上的一个取代基是硝基,②分子中含有-COO-结构的基团,符合条件的同分异构体的结构简式(E、F、G除外)有: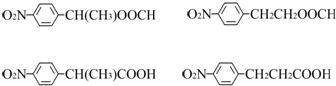 ,
,
故答案为: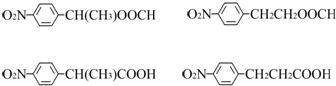 任写2种;
任写2种;
(4)E、F、G中有一种化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,含有羧酸与酚羟基形成的酯基,故种化合物F符合,
故答案为:F;
(5)一定条件下,化合物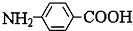 发生聚合反应的化学方程式是:
发生聚合反应的化学方程式是: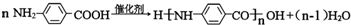 ,
,
故答案为: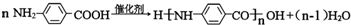 .
.
点评 本题考查有机物的推断与合成,根据甲烷的性质利用顺推法推断,涉及苯同系物、羧酸、醇、酯、氨基酸等性质、同分异构体,难度中等,掌握有机物的性质是解题的关键.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:解答题

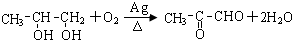 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前 v(正)<v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但它不能解释的事实是邻二溴苯只有一种 | |
| C. | 光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质 | |
| D. | 乙酸乙酯中的少量乙酸可用NaOH溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$ mol的H35Cl分子所含中子数约为6.02×1023 | |
| C. | 3.5 g的35Cl2气体的体积为2.24 L | |
| D. | 35Cl2气体的摩尔质量为70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2;△H3>△H4 | B. | △H1>△H2;△H3<△H4 | C. | △H1=△H2;△H3<△H4 | D. | △H1<△H2;△H3<△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,分子中非金属元素电负性由大到小的顺序为O、N、C、H.
,分子中非金属元素电负性由大到小的顺序为O、N、C、H.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

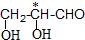 标有*号的碳原子(与其直接相连的4个原子或者原子团互不相同)为手性碳原子,由此把具有手性碳原子的分子称为手性分子.手性分子通常有两种构型,在生理活性等方面有很大的差别.请问青蒿素分子E中共有7个手性碳原子.
标有*号的碳原子(与其直接相连的4个原子或者原子团互不相同)为手性碳原子,由此把具有手性碳原子的分子称为手性分子.手性分子通常有两种构型,在生理活性等方面有很大的差别.请问青蒿素分子E中共有7个手性碳原子.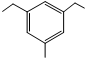 结构.有4种;写出其中一种的结构简式
结构.有4种;写出其中一种的结构简式 任意一种.
任意一种.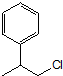 为原料合成
为原料合成 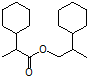 ,写出其合成路线(指明所用试剂和反应条件).
,写出其合成路线(指明所用试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2 g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA | |
| B. | 25℃时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com