
下面的框图是测定CuSO4·xH2O中结晶水含量的实验流程。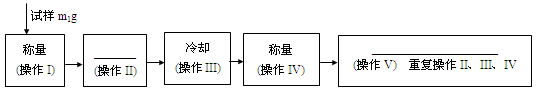
40. 填写流程中空白的操作名称:(操作II)_____________; (操作V)___________________。
41. 其加热装置正确的是____________(填写编号)。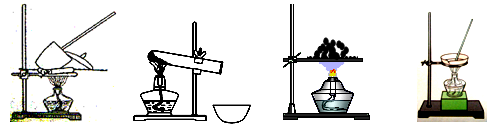
a b c d
42. 重复操作II、III、IV,直到连续两次称量结果相差不超过______g。
43. 操作III必须要在_______(填仪器名称)中进行。
44. 以下胆矾结晶水含量的测定操作正确的是____________(填写编号)。
a. 加热时,晶体溅出坩埚,再加些胆矾
b. 加热时,先用小火,后用大火加热至最后
c. 加热时,不断用玻璃棒搅拌
45. 若实验测得的硫酸铜晶体中结晶水含量偏高,可能的原因有__________(填写编号,下同);若实验测得的硫酸铜晶体中结晶水含量偏低,可能的原因有____________。
a.晶体未完全变白就停止加热
b.加热过程中有少量晶体溅出
c.加热后在空气中自然冷却
40. 加热;恒重。41. a。42. 0.001。43.干燥器;44. c。45. b;a、c。
解析试题分析:40.操作III是冷却,故操作II加热;操作V为检测水是否全部失去,要求质量不再变化,故为恒重。
41. 固体加热需要坩埚,装置为a。
42. 重复操作II、III、IV,直到连续两次称量结果相差不超过电子天平的可读数位0.001g。
43. 操作III必须要在干燥器中进行,防止在空气中冷却时CuSO5吸水。
44. a. 加热时,晶体溅出坩埚,再加些胆矾,不能确定是否与损失的一致,不正确;b. 加热时,先用小火,后用大火加热至最后。CuSO5高温分解,故不正确;c.加热时,不断用玻璃棒搅拌,防止受热不均匀而飞溅,正确。
45. a.晶体未完全变白就停止加热,仍含有水,故测定的结晶水含量偏低;b.加热过程中有少量晶体溅出,溅出CuSO5当做水了,故测定的结晶水含量偏高;c.加热后在空气中自然冷却,CuSO5吸水,故测定的结晶水含量偏低。
考点:测定CuSO4·xH2O中结晶水含量的实验分析与评价。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:填空题
化学实验研究的常用方法,
| A.蒸馏 | B.萃取 | C.过滤 | D.结晶 E.分液 F.纸上层析,请填空(填字母): |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。

回答下列问题:
(1)操作A是_________________(填实验基本操作名称)。用何种方法知道海水晒盐的过程中溶液里食盐含量在逐渐提高?________
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是______(选填编号)。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是____________________________,操作C是_______________________________。
(4)上图中虚线框内流程的主要作用是_______________________;与之目的相同的流程在上图中还有几处,试指出其中一处________________________。
(5)将MgCl2转化为Mg时获得的副产品是_____________,用化学方程式表示该物质的某种用途______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下:
(1)目前,从海水中提取的溴约占世界溴年产量的 。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是 。
(3)步骤④的离子方程式。
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80?90℃。温度过高或过低都不利于生产,理由是 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是 ,分离吋液溴从分离器的 (填“上口”或“下口”)排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”的原因是 。
(7)某同学测得苦卤中溴的含量为0.8g·L-1,已知步骤①?⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(4分)除杂(括号内为杂质)
| 序号 | 物质 | 除杂试剂 |
| (1) | CO2(HCl) | |
| (2) | Fe2O3(Al2O3) | |
| (3) | NaCl溶液(MgCl2) | |
| (4) | NO气体(NO2) | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。请回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用 指示剂,判断到达滴定终点的实验现象是 。
(2)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·L-1的盐酸标准液进行滴定,相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
⑴工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:
①取含杂质的硝酸锶样品, ,搅拌。
② 。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=7~8,过滤。
④将滤液用硝酸调节pH=2~3, ,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
⑵Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式:
(2)观察到A中的现象是 _______________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。
(4)C中盛放CCl4的作用是 。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 ,现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Na2SO3、SO2是中学常见的物质。
(1)某同学用下图示装置制取干燥纯净的SO2。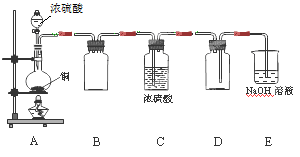
写出制取SO2气体的化学方程式 。请指出D装置中的错误 。若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色。反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告。限选试剂:2 mol/LHCl,1 mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1 mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色。 | ,证明待测液中含Br-。 |
| 步骤② | 在试管B中加入少量待测液, | 有白色沉淀生成, 证明待测液中含SO42-。 |
| 步骤③ | 在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴______(填试剂),振荡。 | , 证明待测液中含SO32-。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com