
| A�� | �ƹ�ʹ������ϴ�·ۣ��Լ���ˮ�帻Ӫ���� | |
| B�� | PM2.5��ָ������ֱ���ӽ���2.5��m��1m=106��m=109nm���Ŀ����Ҳ�ƿ�����������Щϸ�������ɢ�ڿ������γɵķ�ɢϵ�ǽ��� | |
| C�� | Ϊ���ũ�����������ʹ��ũҩ�ͻ��� | |
| D�� | ��ũ����ոѽ��з��ջ���������������� |
���� A����Ϊֲ������Ԫ�أ��ɵ���ˮ����Ⱦ��
B������ķ�ɢϵ�з�ɢ�ʵ�ֱ����1��100nm��
C��ũҩ�ᵼ����Ⱦ��
D�����սոѿɵ��»�����Ⱦ��
��� �⣺A������ϴ�·ۻ���Ⱦˮ��Դ�����ˮ�帻Ӫ������ʹ������ϴ�·ۣ��Լ���ˮ�帻Ӫ��������A��ȷ��
B������ķ�ɢϵ�з�ɢ�ʵ�ֱ����1��100nm��PM2.5��ָ������ֱ���ӽ���2.5��10-6m�Ŀ����ֱ������100nm����ϸ�������ɢ�ڿ������γɵķ�ɢϵ���ǽ��壬��B����
C������ʹ��ũҩ�ͻ��ʻ���Ⱦˮ��������Ӧ����ʹ�ã���C����
D�����ջ�����к�����ͷ۳�����Ⱦ��������D����
��ѡA��
���� ���⿼�黷����Ⱦ��������Ϊ��Ƶ���㣬���ؿ��黯ѧ���������ģ�����������ѧ�������õĿ�ѧ��������ȷ��������Ⱦ�P��Դ���ۺ�Ӧ�ü��ɽ��ע��PM2.5�뽺��Ĺ�ϵ�������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
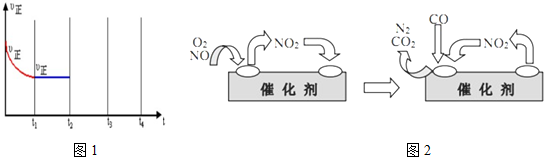
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��ͬ�¶��£�ͬŨ�ȵ���Һ��pH��CH3COONa��Na2CO3��NaHCO3��NaClO | |
| B�� | ͬ��ͬŨ�ȵ�������Һ���٣�NH4��2SO4�ڣ�NH4��2CO3�ۣ�NH4��2FeSO4 c ��NH4+����С���ڣ��٣��� | |
| C�� | ����ʱpH=8��NaOH��Һ��pH=8�İ�ˮ��������pH����8 | |
| D�� | ��1mL0.1mol/L AgNO3��Һ�еμ�3��5��0.1mol/L NaCl��Һ��������ɫ�������ٵ���KI��Һ��������ɻ�ɫ���ɴ��Ƴ���Ksp��AgI����Ksp��AgCl�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+��K+��CO32-��NO3- | B�� | K+��MnO4-��NH4+��NO3- | ||
| C�� | NH4+��SO42-��Al3+��NO3- | D�� | Na+��Ca2+��NO3-��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C��Na+��=2C��S2-��+2C��HS-��+2C��H2S�� | B�� | C��Na+��+C��H+��=C��OH-��+C��HS-��+C��S2-�� | ||
| C�� | C��OH-��=C��H+��+C��HS-��+2��H2S�� | D�� | C��Na+����C��S2-����C��OH-����C��HS-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
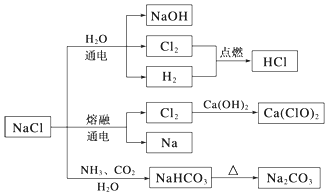
| A�� | ���Ȼ����Ʊ�����Ĺ����У������������ܽ�ȵIJ��� | |
| B�� | ��Cl2�Ʊ�Ư��ʱ���ǽ�Cl2ͨ�����ʯ��ˮ�� | |
| C�� | �����¸����Cl2���ø�ƿ���棬����Cl2��������Ӧ | |
| D�� | ͼʾת����Ӧ����������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ������к���ԭ�ӵ�����Ϊ1.6g | |
| B�� | ԭ��������ʵ���Ũ��Ϊ2.0mol/L | |
| C�� | ��Ӧ�в��������NO�����Ϊ4.48L | |
| D�� | ���������ܽ��ʣ��HNO3Ϊ0.2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
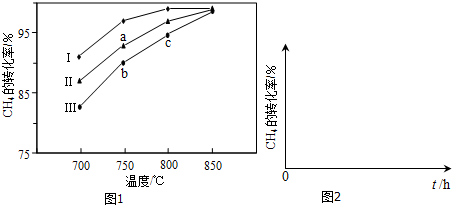
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com