
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为___。利用反应6NO2+8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=﹣196.6kJ·mol-1
2SO3(g) ΔH1=﹣196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH2=﹣113.0kJ·mol-1
2NO2(g) ΔH2=﹣113.0kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=___kJ·mol-1。
SO3(g)+NO(g)的ΔH=___kJ·mol-1。
(3)一定条件下,将2molNO2与2molSO2置于容积固定的恒温密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___(填字母)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1molSO3的同时生成1molNO2
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则SO2的转化率将___(填“增大”“减小”或“不变”)
(4)已知N2O4(g)![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是___。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是___。
A.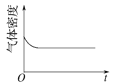 B.
B.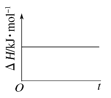 C.
C.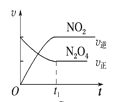 D.
D.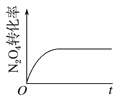
【答案】3NO2+H2O=2HNO3+NO 6.72 -41.8 b 不变 B
【解析】
(1)二氧化氮与水反应生成硝酸与NO;根据转移电子、结合N元素化合价变化计算消耗的NO2的物质的量,再根据V=nVm计算消耗NO2的体积;
(2)根据盖斯定律计算;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则相当于缩小容器的体积,平衡向气体总物质的量减小的方向移动;
(4)化学反应平衡的判断可从以下几方面考虑:体系中所有反应物和生成物的质量(或浓度)保持不变,正反应速率等于逆反应速率。
(1)二氧化氮与水反应生成硝酸与NO,反应方程式为:3NO2+H2O=NO+2HNO3;当转移1.2mol电子时,消耗的NO2物质的量为![]() =0.3mol,消耗NO2的体积为0.3mol×22.4L/mol=6.72L;
=0.3mol,消耗NO2的体积为0.3mol×22.4L/mol=6.72L;
(2)已知:①2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1,②2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1,根据盖斯定律,(①-②)÷2可得:NO2(g)+SO2(g)SO3(g)+NO(g),则△H=[-196.6kJmol-1-(-113.0kJmol-1)]÷2=-41.8kJmol-1;
(3)a.混合气体的总质量和总体积始终不变,则混合气体的密度也始终保持不变,不能说明反应达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.伴随反应的进行SO3和NO的体积比始终保持不变,不能说明反应达到平衡状态,故c错误;
d.每消耗1mol SO3的同时生成1molNO2,均表示逆反应速率,不能判断是否达到平衡状态,故d错误;故答案为b;
该反应达平衡状态后,若再向该容器充入1molNO2与1molSO2,则相当于缩小容器的体积,对反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)而言,平衡不移动,SO2的转化率将不变。
SO3(g)+NO(g)而言,平衡不移动,SO2的转化率将不变。
(4)对于N2O4(g)2NO2(g),反应后体积变大;
A.密度不变,说明体积不变,选项A能说明达到平衡状态,故A正确;
B.△H=E生-E反,△H不随时间的变化,但会随着化学计量数的变化而变化,不能说明达到平衡状态,故B错误;
C.速率之比等于化学方程式计量数之比,图中表示v(NO2)逆=2v(N2O4)正,说明正逆反应速率相等,能说明达到平衡状态,故C正确;
D.N2O4的转化率不变,是平衡标志,说明了化学反应达到平衡状态,故D正确;
故答案为B。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】已知:含C=C的物质(烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A-D间存在图示的转化关系。下列说法不正确的是
![]()
A.D结构简式为CH3COOCH2CH3B.A能使酸性高锰酸钾溶液褪色
C.B与乙酸发生了取代反应D.可用B萃取碘水中的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将ag某物质在足量氧气中充分燃烧再将气体生成物通入足量的Na2O2充分反应,固体增重为bg,若a<b,则该物质可能是( )
A. H2B. COC. 乙酸(CH3COOH)D. 甲烷(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH–;△H>0,下列叙述正确的是
H++OH–;△H>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量稀硫酸,c(H+)增大,Kw不变
D. 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是阿伏伽德罗常数的值,下列说法正确的是( )
是阿伏伽德罗常数的值,下列说法正确的是( )
A.23 g Na在氧气中充分燃烧生成![]() ,转移电子数为2
,转移电子数为2![]()
B.![]() 的NaOH溶液中,含有
的NaOH溶液中,含有![]() 的数日为0.01
的数日为0.01![]()
C.电子数为![]() 的
的![]() 分子的质量为1.6g
分子的质量为1.6g
D.标准状况下,3.36 L的![]() 中含有氧原子的数目为0.45
中含有氧原子的数目为0.45![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2 ) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”、“<”或“=”),作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至100mL,则稀释后溶液中c(Na+):c(OH-)=___。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V2:V1=___。
(5)t2℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)___pH(盐酸)(填“大于”、“小于”或“等于”。下同);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(醋酸)___V(盐酸)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车尾气和燃煤产生的烟气是目前城市空气污染的重要原因之一。NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) H=-akJ·mol-1
2CO2(g)+N2(g) H=-akJ·mol-1
(1)CO可用于炼铁,已知:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H=+489.0kJ/mol
②C(s)+CO2(g)=2CO(g)△H=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为_____________________
(2)在一定温度下,将1.2 mol NO、1.0 mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示。

0~20 min CO2的平均速率v(CO2)=____________,CO的转化率为____________
(3)下列能够说明该反应已经达到平衡的是__________
a.该容器内压强不再改变
b.上述反应的焓变H不变
c. v(NO)=2v(N2)
d.混合气体的密度不再变化
(4)若保持反应体系的温度不变,20 min时再向容器中充CO、CO2各0.2mol,化学平衡将__________(填“逆向”“正向”或“不”)移动。重新达到平衡后,该反应的化学平衡常数为__________(结果保留两位有效数字)
(5)利用反应2NO2+4CO=N2+4CO2可以处理汽车尾气。若将该反应设计为原电池,用熔融NaCO3作电解质,其正极电极反应式为_____________
(6)工业上用氨水将SO2转化为(NH4)2SO3,再氧化为(NH4)2SO4。已知25℃时,0.05mol/L(NH4)2SO4溶液的pH=a,则c(NH4+):c(NH3·H2O)=__________用含a的代数式表示,已知NH3·H2O的电离常数为Kb=1.7×10-5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Na2SO3+2H2O+I2=Na2SO4+2HI; ②Cl2+2Fe2+=2Fe3++2Cl-;③I2+Fe2+不反应,向含SO32-、Fe2+、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的氮循环如图所示。下列说法中,不正确的是( )

A. 工业合成氨属于人工固氮
B. 雷电作用下N2与O2发生化学反应
C. 在氮循环过程中不涉及氧化还原反应
D. 含氮无机物与含氮有机化合物可相互转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com