
【题目】在密闭容器中,将NO2加热到某温度时,可进行如下反应:2NO2(g) ![]() 2NO(g)+O2(g),达到平衡时各物质的浓度分别是c(NO2)=0.06 mol·L-1,c(NO)=0.24 mol·L-1,c(O2)=0.12 mol·L-1。试求:
2NO(g)+O2(g),达到平衡时各物质的浓度分别是c(NO2)=0.06 mol·L-1,c(NO)=0.24 mol·L-1,c(O2)=0.12 mol·L-1。试求:
(1)该反应的化学平衡常数表达式为:_______ ,值为_______。
(2)开始时NO2的浓度为_______。
(3)NO2的转化率为______________。
【答案】![]() 1.92 0.3 mol/L 80%
1.92 0.3 mol/L 80%
【解析】
设开始时NO2的浓度为x,由题给数据可以建立如下三段式:
2NO2(g) ![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
起(mol/L) x 0 0
变(mol/L) 0.24 0.24 0.12
平(mol/L) 0.06 0.24 0.12
(1)化学平衡常数为各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积,平衡时各物质的浓度分别是c(NO2)=0.06 mol·L-1,c(NO)=0.24 mol·L-1,c(O2)=0.12 mol·L-1,则K=![]() =
=![]() =1.92,故答案为:
=1.92,故答案为:![]() ;1.92;
;1.92;
(2)开始时NO2的浓度等于平衡浓度加上变化浓度,则依据三段式数据可知开始时NO2的浓度=(0.24+0.06)mol/L=0.3 mol/L,故答案为:0.3 mol/L;
(3)转化率等于变化量除以起始量,则依据三段式数据可知NO2的转化率=![]() ×100%=80%,故答案为:80%。
×100%=80%,故答案为:80%。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法说法正确的是
A.外接电源保护水中钢闸门时,应将钢闸门与电源的正极相连
B.向Na2CO3溶液中加入少量BaCl2固体,CO32-水解程度增大,溶液的pH减小
C.如图表示常温下稀释pH=11的NaOH溶液和氨水时溶液pH的变化,曲线Ⅱ表示氨水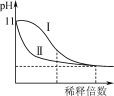
D.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
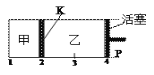
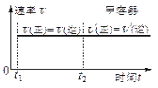

图1 图2 图3
A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于NA下列说法正确的是
A. 常温常压下,17g羟基(—18OH)所含中子数为9NA
B. 0.1mol NH3溶于水形成的溶液中,微粒NH3·H2O和微粒NH4+的数目之和为0.1NA
C. 常温下电解饱和食盐水,当溶液pH值由7变为12时,电路中转移的电子数为0.01NA
D. 标准状况下,足量的甲烷与22.4LCl2(假设氯气完全反应)在光照条件下发生取代反应,形成C-Cl键的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
B. 1mol硝基(-NO2)与46g二氧化氮所含的电子数均为23NA
C. 16.2g14C10H22中含有的共价键数目为3.2NA
D. 向含1molFeI2的溶液中通入1molCl2充分反应,该反应转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法或操作正确的是( )
A.用标准氢氧化钠溶液滴定待测醋酸,选用酚酞作指示剂
B.配制![]() 溶液时,将
溶液时,将![]() 固体溶解在硫酸中,然后再加水稀释到所需的浓度
固体溶解在硫酸中,然后再加水稀释到所需的浓度
C.测定某溶液的pH时,用pH试纸蘸取待测液,然后和比色卡对比得出pH
D.将淀粉溶液加到饱和食盐水中,检验食盐是否是加碘食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中给出了Na2O2与水反应的化学方程式,某学习小组通过实验研究Na2O2与水发反应机理
操作 | 现象 |
Ⅰ | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
Ⅱ | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
Ⅲ | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
(1)Na2O2的电子式为 ______ ,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表示反应的机理,写出Na218O2与H2O反应的化学方程式 ______ .
(2)操作Ⅱ中红色褪去的可能原因是 ______ .
(3)用反应![]() 测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______
测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______ ![]() 填化学式
填化学式![]() 酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______
酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______ ![]() 填酸或碱
填酸或碱![]() 式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
(4)向溶液a中滴加FeSO4溶液,发生反应的离子方程式为______ .
(5)向FeSO4溶液中加入一定量Na2O2固体,并以物质的量为2:1发生反应,反应中无气体生成,写出反应的离子方程式 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com