
【题目】利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g) ![]() N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g) ![]() N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
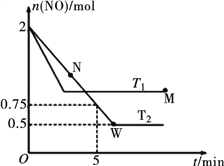
①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g) ![]() 2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) ![]() LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强
【答案】2H2(g)+2NO(g)===N2(g)+2H2O(l) ΔH=-752.1 kJ·mol-1 6.25×10-2 ![]() 或 0.44 < 不变 bc BD
或 0.44 < 不变 bc BD
【解析】
试题本题主要考查热化学方程式的书写,化学平衡图像的分析,化学反应速率和化学平衡常数的计算,外界条件对化学平衡的影响。
(1)将反应编号:2NO(g)![]() N2(g)+O2(g)ΔH=-180.5 kJ·mol-1(①式)
N2(g)+O2(g)ΔH=-180.5 kJ·mol-1(①式)
2H2O(l)=2H2(g)+O2(g)ΔH=+571.6 kJ·mol-1(②式)
应用盖斯定律,①式-②式得2H2(g)+2NO(g)=N2(g)+2H2O(l)ΔH=(-180.5kJ/mol)-(+571.6kJ/mol)=-752.1kJ/mol,H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为2H2(g)+2NO(g)=N2(g)+2H2O(l)ΔH=-752.1kJ/mol。
(2)①T2下在0~5min内,υ(NO)=![]() =
=![]() =0.125mol/(L·min),则υ(O2)=
=0.125mol/(L·min),则υ(O2)=![]() υ(NO)=0.0625mol/(L·min)。由图像可见该温度下达到平衡时n(NO)=0.5mol,用三段式
υ(NO)=0.0625mol/(L·min)。由图像可见该温度下达到平衡时n(NO)=0.5mol,用三段式
2NO(g)![]() N2(g)+O2(g)
N2(g)+O2(g)
n(起始)(mol) 2 0 0
n(转化)(mol) 1.5 0.75 0.75
n(平衡)(mol) 0.5 0.75 0.75
平衡时NO、N2、O2物质的量浓度依次为0.25mol/L、0.375mol/L、0.375mol/L,反应的平衡常数=![]() =
=![]() =
=![]() ,则反应N2(g)+O2(g)
,则反应N2(g)+O2(g)![]() 2NO(g)的平衡常数K=
2NO(g)的平衡常数K=![]() =
=![]() =0.44。
=0.44。
②反应进行到M点转化NO物质的量小于反应进行到W点转化NO物质的量,反应进行到M点放出的热量![]() 进行到W点放出的热量。M点时再加入一定量NO,平衡向正反应方向移动,加入NO相当于增大压强(增大压强平衡不移动),平衡后NO的转化率不变。
进行到W点放出的热量。M点时再加入一定量NO,平衡向正反应方向移动,加入NO相当于增大压强(增大压强平衡不移动),平衡后NO的转化率不变。
③a,该反应中所有物质都呈气态,根据质量守恒定律,气体的总质量始终不变,容器容积不变,混合气体的密度始终不变;b,反应开始逆反应速率为0,反应开始至达到平衡过程中逆反应速率增大,达平衡时逆反应速率不变;c,单位时间内N2的消耗量表示逆反应速率,单位时间内NO的消耗量表示正反应速率,从反应开始至达到平衡的过程中,逆反应速率增大,正反应速率减小,单位时间内N2和NO的消耗量之比增大;d,该反应中所有物质都呈气态,根据质量守恒定律,气体的总质量始终不变,该反应反应前后气体分子数不变,气体分子物质的量始终不变,气体的平均相对分子质量始终不变;从开始至达到平衡的过程,发生变化的是bc,答案选bc。
(3)A,增加LaNi5H6(s)的量,平衡不移动,不会释放出气态氢;B,正反应为放热反应,升高温度平衡向逆反应方向移动,释放出气态氢;C,使用催化剂,平衡不移动,不会释放出气态氢;D,减小压强,平衡向逆反应方向移动,释放出气态氢;使LaNi5H6(s)释放出气态氢,可改变的条件是升高温度、减小压强,答案选BD。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
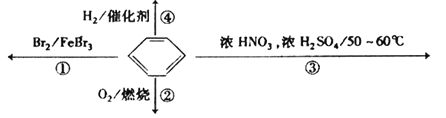
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N0表示阿伏加德罗常数的值,下列说法正确的是
A. 1g H2所含分子数为N0
B. 2g D2O中所含的质子数为N0
C. 0.5 mol/L Na2SO4溶液中所含Na+ 数为N0
D. 标准状况下,4.48 L CCl4所含原子数为N0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“氢能”是未来最理想的新能源。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为_____。(填序号)
A.2H2(g)+O2(g)=2H2O(l) ΔH =-142.9 kJ·mol1
B.H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol1
C.2H2+O2=2H2O(l) ΔH= 571.6 kJ·mol1
D.H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ·mol1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
① CaBr2+H2O![]() CaO+2HBr
CaO+2HBr
② 2HBr+Hg![]() HgBr2+H2↑
HgBr2+H2↑
③ HgBr2+_______![]() ________
________
④ 2HgO![]() 2Hg+O2↑
2Hg+O2↑
⑤2H2+O2![]() 2H2O
2H2O
请你根据“原子经济”的思想完成上述步骤③的化学方程式:___________。并根据“绿色化学”的思想评估该方法制H2的主要缺点_________。
(3)利用核能把水分解制氢气,是目前正在研究的课题。如图是其中的一种流程,其中用了过量的碘。
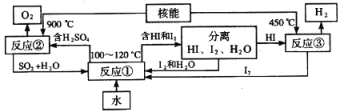
完成下列反应的化学方程式:反应①______________;反应②____________。此法制取氢气的最大优点是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是一氧化碳和氢气的混合气,它由煤炭与水(蒸气)反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式___________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2 220.0 kJmol1。已知CO气体燃烧的热化学方程式为:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJmol1。试比较相同物质的量的C3H8和CO燃烧,产生的热量比值约为_________。
(3)已知氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJmol1。试比较同质量的氢气和丙烷燃烧,产生的热量比值约为______。
(4)氢气是未来的能源,除产生的热量大之外,还具有的优点是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A. 0.02 mol/(Lmin)B. 1.2 mol/(Lmin)
C. 1.8mol/(Lmin)D. 0.18 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ·mol-1 B. -43.5 kJ·mol-1 C. +43.5 kJ·mol-1 D. +67.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3分解有催化作用:
O3+Cl===ClO+O2 ΔH1
ClO+O===Cl+O2 ΔH2
大气臭氧层的分解反应是:O3+O===2O2 ΔH,该反应的能量变化如图:

下列叙述中,正确的是
A. 反应O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸热反应
C. ΔH=ΔH1+ΔH2
D. ΔH=E3-E2>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com